Перейти к:
Диспансерное наблюдение пациентов с фибрилляцией и трепетанием предсердий врачом-терапевтом в первичном звене здравоохранения. Методические рекомендации
https://doi.org/10.15829/3034-4123-2024-24
EDN: IXJDOK
Аннотация
Методические рекомендации содержат описание организации проведения диспансерного наблюдения пациентов с фибрилляцией и трепетанием предсердий врачом-терапевтом, ориентировочный объем и частоту выполнения лабораторно-инструментальных исследований, сведения о диагностике и лечении заболевания, профилактике осложнений.
Методические рекомендации предназначены для врачей-терапевтов участковых, врачей общей практики (семейных врачей), врачей-терапевтов участковых цехового врачебного участка, а также для среднего медицинского персонала, работающего с указанными врачами, для фельдшеров фельдшерско-акушерских пунктов (фельдшерских здравпунктов) в случае возложения на них функций лечащего врача. Методические рекомендации могут быть использованы врачами-организаторами здравоохранения, руководителями медицинских организаций первичной медико-санитарной помощи и их подразделений.
Ключевые слова
Для цитирования:
Драпкина ОМ, Бойцов СА, Голухова ЕЗ, Давтян КВ, Дроздова ЛЮ, Ипатов ПВ, Калинина АМ, Марцевич СЮ, Савченко ЕД, Харлап МС, Шепель РН, Явелов ИС, Жамалов ЛМ. Диспансерное наблюдение пациентов с фибрилляцией и трепетанием предсердий врачом-терапевтом в первичном звене здравоохранения. Методические рекомендации. Первичная медико-санитарная помощь. 2024;1(1):134-178. https://doi.org/10.15829/3034-4123-2024-24. EDN: IXJDOK
For citation:
Drapkina OM, Boytsov SA, Golukhova EZ, Davtyan KV, Drozdova LY, Ipatov PV, Kalinina AM, Martsevich SY, Savchenko ED, Kharlap MS, Shepel RN, Yavelov IS, Zhamalov LM. Outpatient follow-up of patients with atrial fibrillation and flutter by a primary care physician. Guidelines. Primary Health Care (Russian Federation). 2024;1(1):134-178. (In Russ.) https://doi.org/10.15829/3034-4123-2024-24. EDN: IXJDOK
Диспансерное наблюдение пациентов с фибрилляцией и трепетанием предсердий врачом-терапевтом в первичном звене здравоохранения
Многообразие нарушений сердечного ритма определяется различием этиологических факторов, электрофизиологических механизмов развития аритмий и анатомического расположения в сердце тех зон, где эти механизмы реализуются, различием электрокардиографических признаков, клинических проявлений и значением для прогноза жизни. Это, в свою очередь, формирует различия в показаниях к антиаритмической терапии, в ее целях и задачах, стратегии и тактике достижения необходимого результата на основе использования лекарственного и немедикаментозного лечения.
Фибрилляция и трепетание предсердий представляют собой наджелудочковые (суправентрикулярные) тахиаритмии, характеризующиеся наиболее высокой частотой ритма предсердий. В основе возникновения этих нарушений ритма лежат схожие этиологические факторы и патогенетические механизмы, в связи с чем эти аритмии нередко переходят одна в другую [1-3].
Фибрилляция предсердий (ФП) — самая распространенная форма наджелудочковой тахиаритмии, характеризующаяся хаотической электрической активностью предсердий высокой частоты (350-700 в мин) и нерегулярным ритмом желудочков.
Трепетание предсердий (ТП) — наджелудочковая тахиаритмия, характеризующаяся возбуждением предсердий с частотой 250-350 в мин ("волны трепетания" с отсутствием изолинии на электрокардиограмме (ЭКГ)), вследствие процесса macro re-entry вокруг определенного анатомического или функционального препятствия (как правило, с участием трикуспидального клапана).
В большинстве случаев определить точную этиологию ФП не представляется возможным. Наряду с этим существует ряд ассоциированных клинических состояний, являющихся маркерами повышенного риска развития нарушения ритма сердца.
Основными причинами возникновения ФП являются [3]:
- приобретенные или врожденные структурные патологии миокарда, перикарда, клапанного аппарата и/или магистральных сосудов;
- артериальная гипертензия (АГ);
- ишемическая болезнь сердца (ИБС);
- клинически выраженная сердечная недостаточность (СН);
- нарушение функции щитовидной железы;
- возраст (риск развития ФП повышается у лиц старше 40 лет);
- избыточная масса тела и ожирение;
- сахарный диабет (СД);
- употребление алкоголя;
- синдром обструктивного апноэ во время сна.
В 30% случаев при тщательном клинико-инструментальном обследовании не удается выявить каких-либо кардиальных или несердечных факторов развития ФП.
Частота выявления ФП в общей популяции составляет 2-4% [4-6]. Доля лиц с ФП увеличивается с возрастом, доходя до 15% в возрасте 80 лет [7-11]. У мужчин ФП встречается чаще. Риск развития ФП на протяжении жизни составляет около 25% в возрасте старше 40 лет [12-14].
ТП диагностируется приблизительно в 7-10% случаев всех суправентрикулярных тахиаритмий. У мужчин обнаруживается примерно в 4-5 раз чаще. С возрастом частота возникновения ТП увеличивается. Большинство пациентов с ТП имеют те или иные заболевания сердечно-сосудистой системы. У относительно здоровых людей ТП практически не встречается.
В патогенезе ФП/ТП выделяются три ключевых звена:
- Патологический автоматизм отдельных участков миокарда предсердий.
- Ремоделирование миокарда предсердий (фиброз) и, следовательно, электрическая диссоциация мышечных волокон с неоднородностью проведения потенциала действия по миокарду.
- Возникающие вследствие этого множественные кольцевые или спиральные очаги циркуляции возбуждения (re-entry).
Аритмогенный субстрат ФП/ТП представляет собой структурно и функционально измененный (ремоделированный) миокард предсердий, обеспечивающий стойкое самостоятельное поддержание ФП. Под ремоделированием понимают совокупность патологических процессов, возникающих в предсердиях в ответ на возникновение ФП или/и в результате действия известных этиологических факторов.
Ремоделирование начинается с нарушения ионных клеточных механизмов формирования импульса и заканчивается структурно-функциональной деградацией предсердного миокарда и атриомегалией. Основными структурными изменениями миокарда предсердий, предрасполагающими к возникновению субстрата ФП, являются фиброз, воспаление, апоптоз и гипертрофия кардиомиоцитов. Прогрессирование ФП и резистентность к лекарственному и интервенционному лечению, как правило, определяется выраженностью процессов ремоделирования предсердий.
В качестве модулирующего влияния могут также выступать нарушения электролитного обмена (гипокалиемия), преходящая ишемия миокарда и проаритмическое действие лекарственных препаратов. В качестве источника патологического возбуждения чаще всего выступают зоны миокарда в устье легочных вен, ткань которых характеризуется более коротким рефрактерным периодом.
Основными источниками информации по клиническим аспектам проведения диспансерного наблюдения (ДН) пациентов с ФП/ТП являются Клинические рекомендации "Фибрилляция и трепетание предсердий у взрослых", разработанные Российским кардиологическим обществом, Всероссийским обществом специалистов по клинической электрофизиологии, аритмологии и электростимуляции, Ассоциацией сердечно-сосудистых хирургов России, утвержденные Минздравом России и одобренные Научно-практическим Советом Минздрава России в 2020 г. [3].
ДН пациентов с ФП/ТП врачом-терапевтом 1 осуществляется в соответствии с приказом Минздрава России от 15 марта 2022 г. № 168н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми".
ДН у врача-терапевта подлежат пациенты с ФП/ТП при условии отсутствия СД и (или) хронической болезни почек (ХБП) C4 и выше стадии и (или) высокого риска кровотечений в связи с другими заболеваниями 2. Алгоритм диспансерного осмотра пациента с ФП/ТП представлен в таблице 1.
Кроме того, ДН пациентов с ФП/ ТП регламентируются Стандартом медицинской помощи взрослым при фибрилляции и трепетании предсердий (диагностика, лечение и диспансерное наблюдение) 3.
Таблица 1
Алгоритм диспансерного наблюдения врачом-терапевтом пациентов с фибрилляцией/трепетанием предсердия
Заболевание (код МКБ-10) | Регулярность профилактических посещений | Рекомендуемые вмешательства и методы исследования во время профилактических посещений в рамках диспансерного наблюдения |
1 | 2 | 3 |
Заболевание (код МКБ-10) | Регулярность профилактических посещений | Рекомендуемые вмешательства и методы исследования во время профилактических посещений в рамках диспансерного наблюдения |
1 | 2 | 3 |
Фибрилляция и трепетание предсердий (I48.0 — I48.9) | Первое посещение: при взятии под ДН. Далее — по заключению/ рекомендации врача-кардиолога и по медицинским показаниям, но не реже 2-х раз в год. Длительность наблюдения: пожизненно; Примечание: выполнение катетерной аблации ФП/ТП не меняет протокола ДН | Сбор жалоб с оценкой динамики: • ощущение сердцебиения; • одышка; • дискомфорт и тяжесть в груди; • расстройство сна, сонливость; • слабость, головокружение; • полиурия; • потливость, предобморочное состояние; • у ряда пациентов возможно полное отсутствие какой-либо симптоматики. Сбор анамнеза: • сбор полного медицинского и семейного анамнеза для оценки предрасположенности и наличия факторов риска развития ФП/ТП; • наличие в анамнезе: — инсульта; — заболеваний щитовидной железы; — кровотечений и/или предрасположенность к кровотечению (например, геморрагический диатез, анемия и т.д.); — эрозивно-язвенного поражения желудочно-кишечного тракта; — заболеваний печени; — заболеваний почек, в т.ч. мочекаменной болезни и воспалительных заболеваний мочеполовой системы; — хронического геморроя; — миомы матки; — аневризмы аорты и ее ветвей, включая интракраниальные артерии; — сопутствующих сердечно-сосудистых заболеваний: ИБС, гипертонической болезни; — сахарного диабета. |
Физикальное обследование: • антропометрические измерения (рост, вес, окружность талии); • расчет ИМТ; • пальпация пульса на периферических артериях (оценка регулярности, наполнения); • измерение ЧСС; • измерение АД; • оценка наличия и распространенности отеков; • оценка состояния шейных вен (набухание, пульсация); • пальпация щитовидной железы (определение размеров, подвижности и болезненности); • аускультация сердца и легких; • перкуссия, пальпация живота, печени, селезенки; • подсчет частоты дыхательных движений. | ||
Оценка факторов риска и анализ их динамики: • ожирение и избыточная масса тела: ИМТ ≥30 кг/м2 и абдоминальное ожирение (окружность талии >94 см у мужчин и >80 см у женщин) являются независимыми факторами риска развития ФП; • употребление алкоголя: воздержание от алкоголя снижает частоту рецидивов ФП. Всем пациентам рекомендуется отказаться от употребления алкоголя; • статус курения: всем пациентам рекомендуется отказ от курения. Следует разъяснить пациенту патологические последствия курения табака и электронных средств доставки никотина, необходимость лечебно-профилактических мероприятий по оказанию помощи по отказу от курения; • артериальная гипертензия: при АД ≥140/90 мм рт.ст. разъяснить пациенту значимость профилактики повышения уровня АД и его контроля; • физическая активность: умеренная физическая активность снижает риск возникновения ФП, в то время как длительные интенсивные физические тренировки или недостаток физической активности связаны с повышенным риском развития аритмии. Следует разъяснить пациенту пользу регулярных умеренно-интенсивных физических нагрузок и предостеречь от чрезмерной физической нагрузки, особенно в группе пациентов старше 50 лет. | ||
Оценка выраженности симптоматики по шкале EHRА (Приложение 4, таблица 2): • оценка выраженности симптомов аритмии и ее влияния на повседневную деятельность; • использование результатов оценки для назначения лечения, ориентированного на снижение симптоматики и длительного наблюдения за качеством жизни пациента; | ||
Оценка риска тромбоэмболии (Приложение 6): • наличие умеренного или тяжелого митрального стеноза, механических протезов клапанов сердца (высокий риск инсульта и системной ТЭ); • определение суммарного балла риска инсульта/тромбоэмболии по шкале CHA2DS2-VASc (таблица 5) (при отсутствии умеренного или тяжелого митрального стеноза, механических протезов клапанов сердца); • пациентам без факторов риска тромбоэмболии (0 баллов у мужчин, 1 балл у женщин по шкале CHA2DS2-VASc), не получающих антикоагулянты, рекомендуется динамическая оценка баллов по шкале CHA2DS2-VASc, при выявлении дополнительных факторов риска — начало постоянной антикоагулянтной терапии. | ||
Оценка риска кровотечений (Приложение 6): • расчет индекса риска кровотечений по шкале HAS-BLEED (таблица 6); • сумма баллов по шкале HAS-BLED ≥3 указывает на повышенный риск кровотечений, но не означает, что нужно отказаться от антикоагулянтной терапии. Такие пациенты требуют пристального контроля за потенциальными источниками кровотечений и коррекции модифицируемых факторов риска кровотечений; • у пациентов, получающих пероральные антикоагулянты, на каждом визите следует: — активно выявлять факторы риска кровотечений и предпринимать меры по их скорейшей коррекции; — оценивать наличие кровотечений, их выраженность и локализацию, а также возможности эффективного контроля (при необходимости с привлечением соответствующих специалистов). У пациентов с кровотечениями надлежащее дополнительное обследование и лечение должно проводиться в максимально короткие сроки, решение о необходимости коррекции антитромботической терапии должно приниматься с обязательном учетом риска кардиоэмболических осложнений, выраженности и опасности возникающих кровотечений и возможностей устранения их причины. В целом следует стремиться не отменять антитромботическую терапию, а если это неприемлемо — минимизировать сроки прекращения приема антикоагулянтов. При затруднении выбора клинической тактики рекомендуется консультация врача-кардиолога. | ||
Лабораторные исследования (сравнение показателей с нормой и/или целевым уровнем, анализ динамики): • общий (клинический) анализ крови развернутый (с оценкой уровня гемоглобина и гематокрита, количества эритроцитов, лейкоцитов, тромбоцитов, скорости оседания эритроцитов) — не реже 1 раз в год; • биохимический анализ крови с оценкой скорости клубочковой фильтрации (при применении ПОАК — клиренса креатинина) и электролитов (натрия и калия) — не реже 1 раза в год; • исследование уровня тиреотропного гормона в крови, свободного тироксина (СТ4) сыворотки крови — пациентам, находящимся на терапии амиодароном — не реже 1 раз в год, а также пациентам с ФП/ТП при изменении характера течения аритмии: учащение пароксизмов, неэффективность ранее эффективной пульсурежающей терапии при персистирующей/постоянной форме и т.п.; • определение МНО для пациентов, получающих антитромботическую терапию АВК (варфарин) — не реже 8 раз в год; • анализ крови с определением уровня гемоглобина, почечной и печеночной функции — 1 раз в год всем пациентам, длительно получающим ПОАК, кроме перечисленных ниже: — пациентам 75 лет и старше или со старческой астенией — 1 раз в 4-6 мес.; — при клиренсе креатинина <60 мл/мин — 1 раз в N месяцев, где N = клиренс креатинина /10; — дополнительно, если какое-либо интеркуррентное заболевание могло повлиять на почечную или печеночную функцию; • общий (клинический) анализ мочи — при наличии показаний, с целью уточнения степени активности сопутствующих заболеваний. При необходимости указанные исследования производятся по согласованию с соответствующим врачом-специалистом. | ||
Обследование пациентов с ФП/ТП перед назначением антикоагулянтной и антиаритмической терапии: • при назначении любого антикоагулянта рекомендовано провести обследование, направленное на: — исключение анемии и тромбоцитопении; — определение функции печени и почек; — выявление потенциальных источников кровотечений; • особое внимание необходимо обращать на наличие эрозивно-язвенного поражения желудочно-кишечного тракта, заболеваний печени, мочекаменной болезни и воспалительных заболеваний мочеполовой системы, хронического геморроя, злокачественных новообразований, миомы матки, аневризмы аорты и ее ветвей, включая интракраниальные артерии; • всем пациентам с гематурией показано проведение ультразвуковое исследование почек и мочевыводящих путей для исключения мочекаменной болезни, опухолей, воспалительных заболеваний и т.п.; • женщинам с анамнезом аномальных маточных геморрагий показан осмотр врача-гинеколога с целью исключения дисфункциональных кровотечений и опухолей как причины кровотечений; • для исключения анемии и тромбоцитопении всем пациентам перед назначением ПОАК рекомендовано проведение развернутого клинического анализа крови (с определением уровня гемоглобина, количества эритроцитов, количества тромбоцитов); • для исключения патологии печени — определение уровня гепатоспецифических ферментов (АСТ, АЛТ), общего билирубина, общего белка; • для выявления хронической болезни почек и определения ее стадии — определение уровня креатинина крови с расчетом клиренса креатинина по формуле Кокрофта-Голта; • для исключения нарушения синтеза факторов свертывания в печени — определение исходного значения МНО; • перед назначением амиодарона целесообразно выполнение рентгенологического исследования легких и оценка уровня тиреотропного гормона и гормонов щитовидной железы (Т4 свободный); | ||
Инструментальные исследования: • ЭКГ в покое с использованием 12 стандартных отведений — 2 раза в год; • суточное мониторирование ЭКГ по Холтеру — не реже 1 раза в год; • ЭхоКГ — не реже 1 раза в год; • ЭГДС для исключения обострения язвенной болезни и наличия острых эрозий при наличии в анамнезе эпизодов кровотечения, эрозивно-язвенных поражений желудочно-кишечного тракта; • рентгенография легких — 1 раз в год пациентам, получающим амиодарон; • исследование функции внешнего дыхания — не реже 1 раза в год пациентам, получающим амиодарон. Уточнение факта приема лекарственных препаратов с оценкой их совместимости: • показаний и противопоказаний к применению; • наименований, доз и длительности приема. Определение приверженности к проводимому лечению и его эффективности по оценке самого пациента, выявление причин невыполнения ранее назначенного лечения (Приложение 14). Консультации врачей-специалистов: • врач-кардиолог — при ухудшении состояния или прогрессировании основного заболевания сердечно-сосудистой системы на фоне проводимого лечения пациентам с ФП/ТП рекомендована внеочередная консультация для решения вопроса об объеме обследования, коррекции терапии и целесообразности госпитализации в профильный стационар. | ||
Оценка достижения целевых показателей здоровья: • уровень АД не >140/90 мм рт.ст. или целевой уровень в соответствии с планом лечения; • уровень общего холестерина в сыворотке крови не более 5 ммоль/л; • уровень глюкозы крови натощак <6,0 ммоль/л; • ИМТ 18,5-24,9 кг/м2, окружность талии <94 см (мужчины) и <80 см (женщины); • прекращение воздействия табака в любой форме; • отказ от употребления алкоголя; • здоровое питание с исключением трансжиров, с низким содержанием насыщенных жиров, с акцентом на потребление цельнозерновых продуктов, овощей, фруктов и рыбы (при отсутствии противопоказаний и/или ограничений); • физическая активность умеренной интенсивности — не менее 150-300 мин в неделю, высокой интенсивности — не менее 75-150 мин в неделю (при отсутствии противопоказаний и/или ограничений); • другие целевые показатели в соответствии с индивидуальным планом лечения по основному заболеванию, в т.ч.: — стабильный уровень МНО с пребыванием в терапевтическом диапазоне не менее 70٪ у пациентов, принимающих антагонисты витамина К; — ЧСС; — скорость клубочковой фильтрации (не реже 1 раза в год); — показатель общего холестерина крови (не реже 1 раза в год), а при его повышенных значениях — холестерина липопротеидов низкой плотности. Краткое профилактическое консультирование (при наличии факторов риска) включает обсуждение всех имеющихся индивидуальных факторов риска (см. выше), рекомендации по профилактике модифицируемых факторов, психоэмоционального стресса, что важно для всех пациентов, особенно с отягощенным наследственным анамнезом. | ||
Назначение или корректировка немедикаментозной и медикаментозной терапии: • коррекция модифицируемых факторов риска кровотечений: — исключение необоснованного приема лекарств (прежде всего нестероидных противовоспалительных препаратов); — коррекция частично модифицируемых факторов риска кровотечений (лечение анемии, тромбоцитопении, коррекция нарушений функции почек и печени); • контроль объема потребляемой жидкости; • коррекция электролитных нарушений; • коррекция антиаритмической терапии (при неэффективной ААТ — по согласованию с врачом-кардиологом); • коррекция антитромботической терапии; • коррекция терапии сопутствующих заболеваний. Определение показаний к госпитализации (Приложение 15). Определение наличия показаний и отсутствия противопоказаний для направления на санаторно-курортное лечение (Приложение 7). | ||
Информирование пациента о результатах проведенного диспансерного осмотра: • информирование о течении болезни по данным объективной оценки; • выдача рекомендаций, информирование о целевых уровнях показателей здоровья, имеющихся факторах риска; • информирование о необходимости регулярного динамического диспансерного наблюдения (не реже 2-х раз в год); • информирование о необходимости прохождения диспансеризации и ежегодного профилактического медицинского осмотра, а также углубленной диспансеризации 4; • обучение пациента алгоритмам действий при ухудшении состояния, в том числе информирование в доступной форме о первых симптомах инсульта или транзиторной ишемической атаки. Разъяснение лицу с высоким риском развития жизнеугрожающего состояния (осложнения заболевания) и лицам, совместно с ним проживающим, правил неотложных действий (первой помощи) при их развитии и необходимости своевременного вызова скорой медицинской помощи; • назначение даты следующего диспансерного осмотра. | ||
Направление на вакцинацию: • против гриппа — ежегодно в августе-сентябре; • против пневмококковой инфекции в соответствии с иммунным статусом пациента; • против других инфекционных заболеваний 5; • проверка/составление индивидуального плана вакцинопрофилактики; Направление пациента с наличием факторов риска ХНИЗ в отделение/кабинет медицинской профилактики или центр здоровья для проведения углубленного профилактического консультирования с целью коррекции факторов риска. Направление в отделение (кабинет) медицинской реабилитации/на консультацию к врачу по физической и реабилитационной медицине (врачу по медицинской реабилитации) для определения индивидуальной маршрутизации пациента при реализации мероприятий по медицинской реабилитации. Оформление медицинской документации: • формы № 025/у "Медицинская карта пациента, получающего медицинскую помощь в амбулаторных условиях", • формы № 030/у "Контрольная карта диспансерного наблюдения" 6; • формы № 057/у-04 "Направление на госпитализацию, восстановительное лечение, обследование, консультацию" (при необходимости) 7. |
Сокращения: ААТ — антиаритмическая терапия, АВК — антагонисты витамина К, АД — артериальное давление, АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ДН — диспансерное наблюдение, ИБС — ишемическая болезнь сердца; ИМТ — индекс массы тела, МНО — международное нормализованное отношение, ПОАК — прямые пероральные антикоагулянты, ТП — трепетание предсердий, ТЭ — тромбоэмболия, ФП — фибрилляция предсердий, ХНИЗ — хронические неинфекционные заболевания, ЧСС — частота сердечных сокращений, ЭГДС — эзофагогастродуоденоскопия, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
Приложение 1. Классификация фибрилляции и трепетания предсердий [2]
Согласно классификации H. Wells (1979) выделяют два типа ТП:
- типичное трепетание (тип I). Наблюдается у 90% пациентов. Характеризуется распространением волны macro re-entry против часовой стрелки (наиболее часто) или по часовой стрелке (существенно реже) вокруг трехстворчатого клапана. Характерной особенностью данного типа ТП является обязательное повторное прохождение волны возбуждения по так называемому кавотрикуспидальному истмусу (перешейку);
- атипичное трепетание (тип II). К нему относятся все остальные виды предсердного macro re-entry, не включающие в состав цепи повторного входа возбуждения область кавотрикуспидального истмуса.
В зависимости от частоты ритма желудочков различают следующие формы ФП/ТП:
- нормосистолическая— частота в диапазоне от 60 до 100 уд./мин (рисунок 1А);
- тахисистолическая— частота более 100 в мин (рисунок 1Б);
- брадисистолическая— частота менее 60 в мин.
По характеру течения и длительности аритмии выделяют 5 типов ФП/ТП:
- впервые выявленная— любой впервые диагностированный эпизод вне зависимости от длительности и выраженности симптомов;
- пароксизмальная— повторно возникающая (2 и более эпизодов), способная самостоятельно прекращаться до истечения 7 сут. от момента начала приступа. К пароксизмальной также относят ФП/ТП, купированную с применением медикаментозной или электрической кардиоверсии в сроки от 48 ч до 7 дней от момента начала аритмии;
- персистирующая— первично или повторно возникшая ФП длительностью более 7 сут., не способная к спонтанному прерыванию и требующая для своего устранения проведения специальных мероприятий (обычно электрической кардиоверсии);
- длительно персистирующая— ФП/ТП продолжительностью более года, при условии выбора стратегии контроля ритма;
- постоянная (хроническая) — ФП продолжительностью более 7 сут., если попытки ее устранения неэффективны или не предпринимаются по тем или иным причинам (принято согласованное решение не осуществлять попытки восстановления сердечного ритма).
Приложение 2. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по МКБ-10 8
I48.0 | Пароксизмальная фибрилляция предсердий |
I48.1 | Персистирующая фибрилляция предсердий |
I48.2 | Хроническая фибрилляция предсердий |
I48.3 | Типичное трепетание предсердий. Тип I |
I48.4 | Атипичное трепетание предсердий. Тип II |
I48.9 | Фибрилляция предсердий и трепетание предсердий неуточненное |
Примеры формулировки клинического диагноза
ИБС. Постинфарктный кардиосклероз (2001, 2002, 2003 гг.). Персистирующая форма фибрилляции предсердий, приступ с 03.04.2023. Класс по EHRA III, сумма баллов по шкале CНА2DS2-VASc 5, сумма баллов по шкале HAS-BLED 19.
ИБС. Стенокардия напряжения II функционального класса (ФК). Пароксизмальная форма фибрилляции предсердий, пароксизм от 03.04.2021. Класс по EHRA IIb, сумма баллов по шкале CHA2DS2-VASc 5, сумма баллов по шкале HAS-BLED 1.
Фибрилляция предсердий, персистирующая форма, приступ от марта 2021 г. Класс по EHRA IIа, сумма баллов по шкале CНА2DS2-VASc 2, сумма баллов по шкале HAS-BLED 0.
Впервые диагностированная фибрилляции предсердий, пароксизм от 14.04.2024, купирован медикаментозно 15.04.2024. Класс по EHRA IIb, сумма баллов по шкале CНА2DS2-VASc 4, сумма баллов по шкале HAS-BLED 1.
Приложение 3. Диагностика фибрилляции и трепетания предсердий
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
Основным исследованием, применяемым для диагностики аритмий, в т.ч. ФП/ТП, является ЭКГ.
Для выявления и идентификации может потребоваться использование других электрокардиографических методик: суточного (многосуточного) холтеровского мониторирования ЭКГ (ХМ ЭКГ), носимых и имплантируемых "регистраторов кардиологических событий" и т.д.
Всем пациентам с диагностированной ФП показано проведение эхокардиографического обследования (ЭхоКГ) для оценки структурных и функциональных изменений сердца.
ЭКГ в 12 стандартных отведениях и суточное мониторирование ЭКГ проводятся с целью динамического контроля за прогрессированием аритмии, эффективностью и безопасностью антиаритмической и пульс-урежающей терапии, эффективностью катетерной аблации, а также выявления новых нарушений сердечного ритма и проводимости, ишемии миокарда и признаков структурной патологии сердца.
ХМ ЭКГ проводится в качестве скрининга у пациентов после ишемического инсульта, транзиторной ишемической атаки (оптимальная продолжительность мониторирования не менее 72 ч), для обнаружения коротких пароксизмов ФП при наличии симптоматики, оценки эффективности контроля частоты сердечных сокращений (ЧСС) при ФП.
При наличии в анамнезе эпизодов кровотечения, эрозивно-язвенных поражений желудочно-кишечного тракта рекомендовано проведение эзофагогастродуоденоскопии для исключения обострения язвенной болезни и наличия острых эрозий [15-19].
При диагностированной железодефицитной анемии, без известного источника кровотечения, рекомендовано проведение колоноскопии [18, 20].
Характерными ЭКГ-признаками ФП являются:
- отсутствие зубцов Р;
- наличие разноамплитудных, полиморфных волн ff, переходящих одна в другую без четкой изолинии между ними;
- абсолютная хаотичность и нерегулярность ритма желудочков (рисунок 1).
Трепетание предсердий на ЭКГ представляет собой правильный высокоамплитудный предсердный ритм с высокой частотой (250-350 уд./мин) и отсутствием четкой изоэлектрической линии между предсердными комплексами (волнами F) хотя бы в одном ЭКГ-отведении.
Ведущим ЭКГ-признаком типичного ТП являются "пилообразные" предсердные волны F с наибольшей амплитудой в отведениях II, III и aVF, а также с отсутствием изолинии между ними в этих или других отведениях ЭКГ.
Из-за высокой частоты предсердной импульсации ТП практически всегда протекает с атриовентрикулярной (АВ)-блокадой II степени и определённой, нередко меняющейся кратностью предсердно-желудочкового проведения. При постоянной кратности АВ-проведения говорят о правильной форме ТП (рисунок 2), при непостоянной кратности — о неправильной форме ТП (рисунок 3).
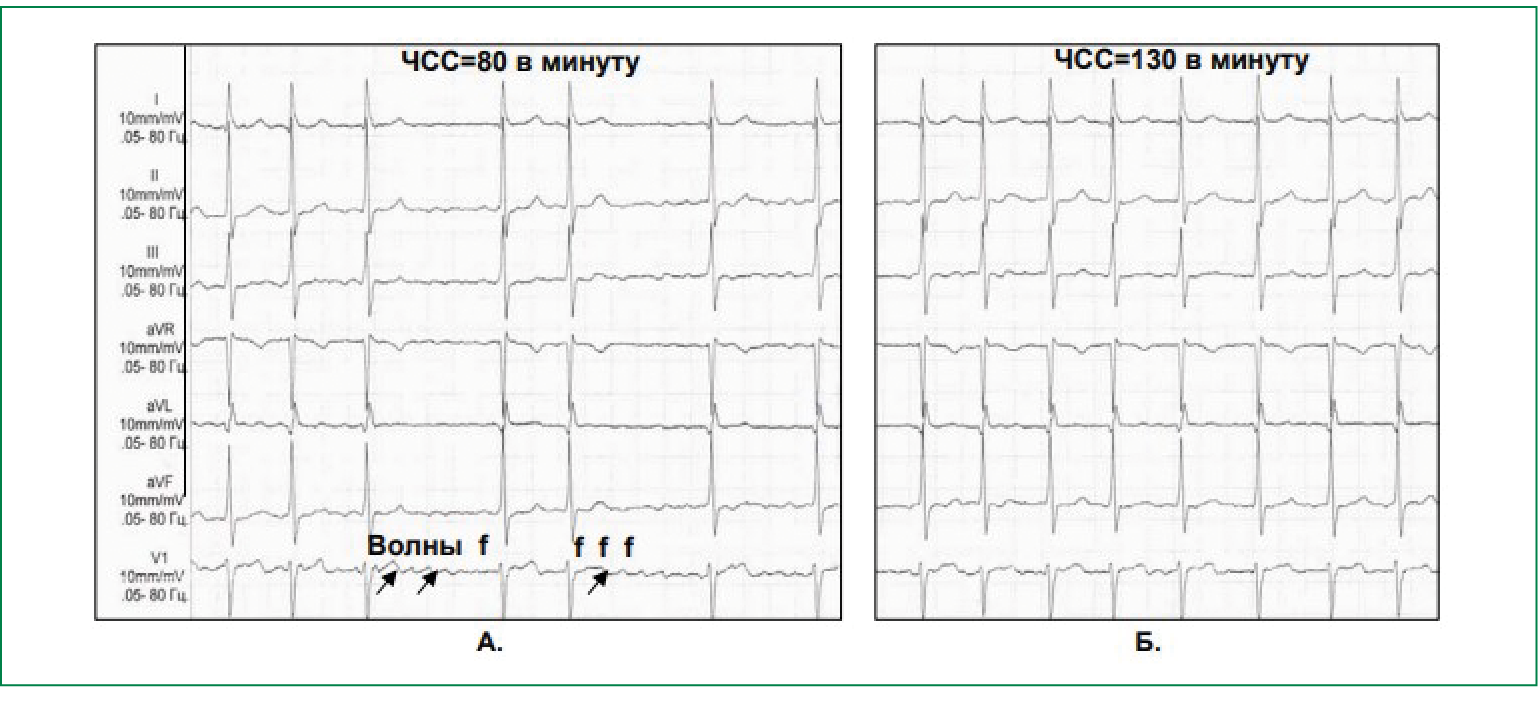
Рис. 1. ФП (А — нормосистолическая форма, Б — тахисистолическая форма).
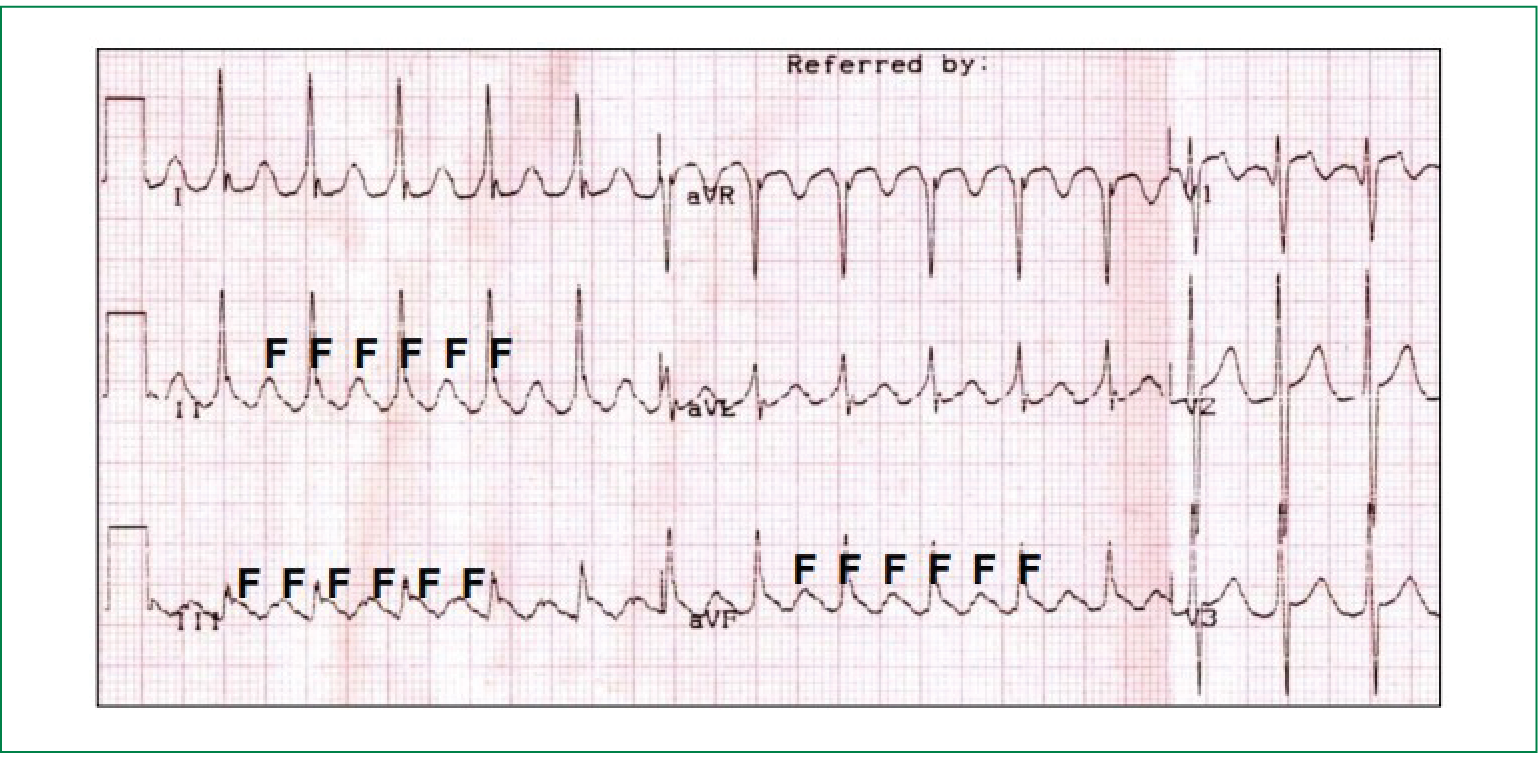
Рис. 2. Правильная форма ТП с частотой предсердной импульсации (волн F) 280 в минуту и проведением
на желудочки 2.
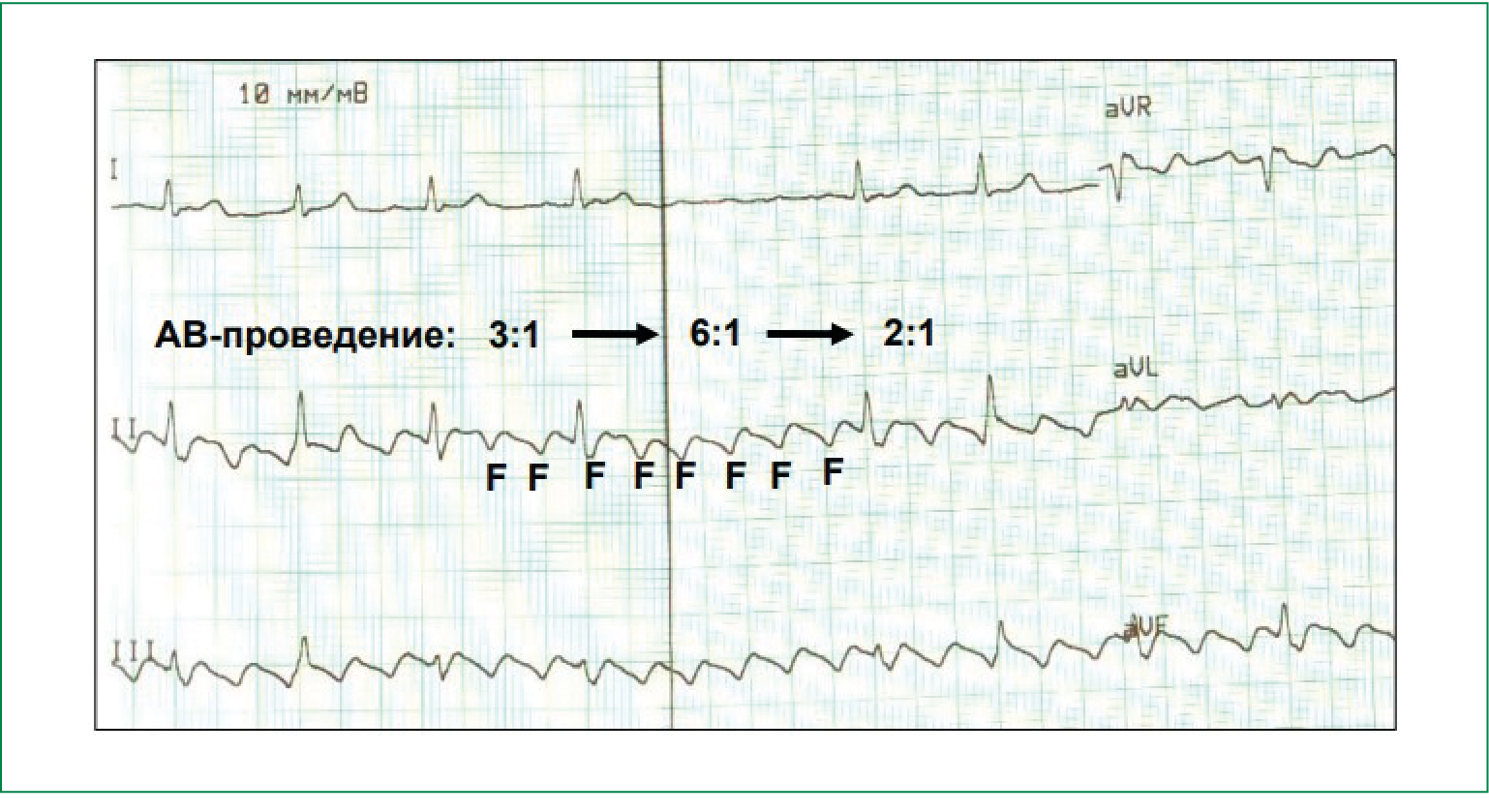
Рис. 3. Неправильная форма ТП с частотой предсердной импульсации (волн F) 250 в минуту и кратностью проведения на желудочки от 2:1 до 6:1.
Приложение 4. Клиническая картина
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
Для оценки выраженности симптомов аритмии и ее влияния на повседневную деятельность рекомендуется использование модифицированной шкалы EHRA (шкала оценки тяжести симптомов, связанных с фибрилляцией предсердий Европейской ассоциации ритма сердца) (таблица 2) [3][21]. Ее использование целесообразно для назначения лечения, ориентированного на снижение симптоматики и длительного наблюдения за качеством жизни пациентов.
Таблица 2
Модифицированная шкала EHRА
Класс EHRA | Проявления | Описание |
I | Симптомов нет | ФП не вызывает симптомов |
IIa | Легкие симптомы | Нормальная повседневная деятельность не нарушается от симптомов, связанных с ФП |
IIb | Средневыраженная симптоматика | Ощущения, связанные с ФП, беспокоят пациента, |
III | Выраженная симптоматика | Нормальная повседневная активность нарушается из-за симптомов, вызванных ФП |
IV | Инвалидизируюшие симптомы | Нормальная повседневная активность невозможна |
Сокращение: ФП — фибрилляция предсердий.
При осмотре пациента в момент аритмии обращает на себя внимание аритмичный пульс, возможен дефицит пульса вследствие того, что при частом желудочковом ритме ударный объем левого желудочка (ЛЖ) недостаточен для создания периферической венозной волны.
Приблизительно в четверти случаев аритмия может протекать бессимптомно и выявляется случайно при медицинском осмотре.

Кроме того, ФП может быть причиной когнитивных дисфункций, включая сосудистую деменцию. Неблагоприятные исходы ФП приведены в таблице 3.
При длительности ФП/ТП свыше 48 ч у пациентов увеличивается вероятность тромбообразования в предсердиях (прежде всего в ушке левого предсердия). Именно поэтому наиболее опасными осложнениями ФП/ТП являются тромбоэмболические, в том числе ишемический кардиоэмболический инсульт, тромбоэмболии сосудов конечностей и инфаркты внутренних органов [3].
Таблица 3
Неблагоприятные исходы ФП
Событие | Изменение риска при наличии ФП |
Смерть | Увеличение частоты смертей за счет сердечно-сосудистых причин, инсульта, сердечной недостаточности и внезапной смерти |
ОНМК (включая геморрагический инсульт, и внутричерепное кровоизлияние) | С ФП связаны 20-30٪ всех инсультов. У части пациентов с инсультом диагностируется асимптомная ФП |
Госпитализация | Ежегодно госпитализируется 10-40٪ пациентов с ФП |
Снижение качества жизни и переносимости физической нагрузки | Качество жизни пациентов с ФП снижается независимо от наличия другой сердечно-сосудистой патологии |
Снижение функции ЛЖ и сердечная недостаточность | Дисфункция ЛЖ обнаруживается у 20-30٪ пациентов с ФП. У многих пациентов ФП нарушает и ухудшает насосную функцию ЛЖ |
Когнитивные нарушения, и сосудистая деменция | Когнитивные нарушения и сосудистая деменция могут возникнуть даже у пациентов, получающих антикоагулянтную терапию. У пациентов с ФП очаги в белом веществе головного мозга встречаются чаще, чем у лиц без ФП |
Сокращения: ЛЖ — левый желудочек, ОНМК — острое нарушение мозгового кровообращения, ФП — фибрилляция предсердий.
Несмотря на то, что смертность от острого нарушения мозгового кровообращения может быть значительно снижена с помощью антикоагулянтной терапии, смертность от СН или внезапная сердечная смерть остается частой даже у тех пациентов с ФП, которые получают лечение в соответствии с современными подходами [27].
ФП диагностируется у 20-30% пациентов с ишемическим инсультом (ИИ) [28-30]. Наряду с этим часто обнаруживаются очаги в белом веществе головного мозга (скрытая ишемия мозга), когнитивная дисфункция и сниженное качество жизни [31].
Отдельной проблемой выделяются осложнения терапии ФП:
- геморрагические осложнения антикоагулянтной терапии (наиболее опасные — внутричерепные кровоизлияния, наиболее частые — желудочно-кишечные кровотечения);
- проаритмические эффекты антиаритмических препаратов.
Основные причины госпитализаций при ФП — острый коронарный синдром (ОКС), СН, тромбоэмболические осложнения и необходимость неотложного купирования ФП.
Приложение 5. Лечение фибрилляции и трепетания предсердий
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
Медикаментозное лечение
Лечение пациентов с ФП/ТП проводится с целью уменьшения выраженности симптомов, улучшения гемодинамических показателей, профилактики возможных осложнений.
Применяются две альтернативные терапевтические стратегии:
- "Контроль частоты"— снижение частоты сокращений желудочков на фоне сохраняющейся ФП/ТП, с применением ритмурежающих лекарственных средств и воздержанием от собственно противоаритмического лечения;
- "Контроль ритма сердца"— восстановление (при необходимости) и как можно более длительное сохранение синусового ритма (СР) лекарственными противоаритмическими средствами.
Выбор стратегии лечения ФП определяется индивидуально — в зависимости от характера течения аритмии, степени выраженности клинических проявлений, наличия сопутствующих заболеваний, переносимости различных групп препаратов и при обязательном учете мнения лечащего врача и предпочтения пациента (таблица 4).
Таблица 4
Критерии выбора стратегии лечения фибрилляции предсердий
В пользу контроля ритма | В пользу контроля ЧСС |
Симптомная ФП (оценка по шкале EHRA IIb-IV) | Асимптомное или малосимптомное течение (EHRA I-IIа) |
Активный образ жизни | Малоподвижный образ жизни |
Эффективный контроль ритма при назначении антиаритмических препаратов | Неэффективный контроль антиаритмическими препаратами или невысокая вероятность удержания сердечного ритма (ЛП >5 см) |
Молодой возраст | Пожилой возраст |
Минимальная коморбидность или её отсутствие | Наличие коморбидности |
Отсутствие ХСН или ХСН I-II ФК | Наличие ХСН III-IV ФК |
Предпочтения пациента |
Сокращения: ЛП — левое предсердие, ФК — функциональный класс, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ЧСС — частота сердечных сокращений.
Проведение противоаритмического лечения по "контролю ритма сердца" не избавляет от необходимости параллельного "контроля частоты", так как всегда существует вероятность рецидива ФП, которая не должна протекать с избыточно высоким ритмом желудочков [3].
Стратегия "контроль частоты" сердечного ритма предусматривает два варианта, определяющих целевой уровень ЧСС (частоты сокращений желудочков) у пациентов с ФП:
- Строгий контроль — 80 уд./мин в покое, 110 уд./мин при умеренной физической нагрузке;
- Мягкий контроль — 110 уд./мин в покое.
Препаратами первой линии для контроля частоты желудочкового ритма при ФП у пациентов с нормальной или незначительно сниженной сократительной функцией (фракция выброса (ФВ) ЛЖ ≥40%) являются бета-адреноблокаторы или недигидропиридиновые антагонисты кальция (верапамил, дилтиазем)) [32-35].
Бета-адреноблокаторы и/или дигоксин рекомендуются для контроля ЧСС при ФП у пациентов со сниженной сократительной функцией ЛЖ (ФВ ЛЖ <40%) [40-45].
При неэффективности или невозможности использования других ритмурежающих препаратов, а также пациентам с нестабильной гемодинамикой или значительно сниженной ФВ ЛЖ рекомендовано применение амиодарона для контроля ЧСС [46-49].
Применение комбинаций различных препаратов, влияющих на частоту желудочкового ритма при ФП, рекомендовано в случаях, когда при использовании одного лекарственного препарата не удается достичь целевых значений ЧСС [36-39]. Комбинированное назначение бета-адреноблокаторов и недигидропиридиновых антагонистов кальция недопустимо вследствие высокого риска выраженного отрицательного инотропного действия.
Стратегия "контроль ритма" сердца предполагает попытку восстановления и поддержания СР.
С целью достижения успешного долгосрочного результата необходимо не только проведение кардиоверсии (восстановление СР), но и поддерживающая антиаритмическая терапия, профилактика и лечение сопутствующих заболеваний, модификация образа жизни пациента [50].
Для планового восстановления ритма у пациентов с ФП рекомендуется применение фармакологической или электрической кардиоверcии (Приложения 9, 10) [54].
Фармакологическая кардиоверсия показана только гемодинамически стабильным пациентам [55]. Пациентам с пароксизмальной формой фибрилляции предсердий, без сопутствующего структурного заболевания сердца или ИБС, при условии продолжительности аритмии <48 ч для восстановления СР может быть рекомендован метод "таблетки в кармане" — для купирования пароксизма ФП используется нагрузочная доза в виде однократного самостоятельного перорального приема пропафенона в дозе 450-600 мг. Суточная доза пропафенона не должна превышать 900 мг [56].
При внутривенном введении для восстановления СР при недавно начавшейся ФП (продолжительность до 48 ч) эффективны пропафенон, прокаинамид и амиодарон [57].
При малосимпомном характере пароксизма у пациентов с недавно начавшейся ФП как альтернатива ранней кардиоверсии может быть рассмотрена стратегия "выжидания и наблюдения" (обычно до 24 ч) [58].

Поддержание СР у пациентов с ФП
Принципы антиаритмической терапии для поддержания СР [59]:
- эффективность антиаритмических препаратов для поддержания СР невысока;
- клинически успешная антиаритмическая терапия может уменьшить бремя ФП, но не устранить её рецидивы;
- если один из антиаритмических препаратов (ААП) оказывается неэффективным, возможно назначение другого лекарственного препарата;
- ААП обладают собственным проаритмогенным эффектом, а также могут вызывать экстракардиальные побочные эффекты;
- выбор ААП должен быть основан в первую очередь на его безопасности, а не эффективности.
В Приложении 11 (таблицы 9, 10) представлены рекомендации по выбору и дозировке ААП для лечения ФП и поддержания СР, в Приложении 12 — тактика подбора ААП для профилактики пароксизмов ФП.
Немедикаментозное лечение
Плановая электрическая кардиоверсия с целью восстановления СР при ФП рекомендуется при неэффективности антиаритмических препаратов, противопоказании к их применению, а также в случае, если лечащий врач и пациент отдают предпочтение этому способу восстановления ритма. Предварительное назначение пропафенона, амиодарона или соталола рекомендовано для повышения эффективности электрической кардиоверсии и профилактики рецидивов ФП [60-62].
Катетерная аблация каво-трикуспидального истмуса является методом выбора при лечении пациентов с повторными пароксизмами ФП, типичного ТП и при персистирующем типичном ТП. Данное вмешательство позволяет добиться радикального устранения аритмии у подавляющего большинства (>90%) пациентов.
Катетерная аблация рекомендована в качестве первой линии лечения отдельным пациентам с пароксизмальной ФП в качестве альтернативы антиаритмического лекарственного лечения.
Катетерная аблация рекомендована симптомным пациентам с ФП и СН со сниженной ФВ ЛЖ для улучшения симптомов и насосной функции сердца.
Хирургическая аблация рекомендована симптомным пациентам с персистирующей или длительно персистирующей формами ФП, рефрактерными к антиаритмической терапии.
Мини-инвазивное (торакоскопическое вмешательство) рекомендовано пациентам с симптомной ФП, когда оказалась неэффективной катетерная аблация.
Приложение 6. Антитромботическая терапия у пациентов с фибрилляцией и трепетанием предсердий
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020; клинических рекомендаций ЕОК по лечению фибрилляции предсердий, 2024.
Высокий риск ишемического инсульта и системных (артериальных) тромбоэмболий (ТЭ), имеющих чаще всего кардиоэмболическое происхождение (тромбообразование в ушке, реже в полости левого предсердия), является важнейшей проблемой для пациентов с ФП. В структуре всех тромбоэмболических осложнений у пациентов с ФП >90% приходится на ИИ. Cреди ИИ кардиоэмболический имеет наиболее плохой прогноз, что обусловлено высокой смертностью и развитием стойкой инвалидизации.

Основными антитромботическими препаратами для профилактики инсульта и системных эмболий у пациентов с ФП являются пероральные антикоагулянты. К ним относятся антагонисты витамина К (АВК) и прямые пероральные антикоагулянты — ингибитор тромбина (дабигатрана этексилат, далее дабигатран) и ингибиторы X фактора (апиксабан, ривароксабан, эдоксабан). Выбор антитромботической терапии основывается на абсолютных рисках инсульта/ТЭ и кровотечения, а также совокупного клинического преимущества для данного пациента.
Оценка риска инсульта/ТЭ
Показания к проведению антитромботической терапии определяются не формой ФП (пароксизмальная, персистирующая или постоянная), а зависят от имеющегося количества факторов риска развития инсульта/ТЭ. Риск инсульта и системной ТЭ наиболее высок при умеренном или тяжелом митральном стенозе, а также при наличии механических протезов клапанов сердца. В остальных случаях для индивидуальной оценки риска необходимо определить сумму баллов по шкале CHA2DS2-VASc (таблица 5).

Постоянный прием пероральных антикоагулянтов с целью профилактики тромбоэмболических осложнений необходим пациентам с умеренным или тяжелым митральным стенозом, механическими протезами клапанов сердца, а при отсутствии этой патологии — пациентам мужского пола с суммой баллов по шкале CHA2DS2-VASc ≥2 и пациентам женского пола с суммой баллов по шкале CHA2DS2-VASc ≥3.
При отсутствии умеренного или тяжелого митрального стеноза, механических протезов клапанов сердца, мужчинам с суммой баллов по шкале CHA2DS2-VASc =1 и женщинам с суммой баллов =2, имеющим невысокий риск инсульта/ТЭ, назначение пероральных антикоагулянтов осуществляется с учетом индивидуальных особенностей (включая наличие дополнительных факторов риска, не входящих с состав шкалы CHA2DS2-VASc) и предпочтений пациента.
У мужчин с суммой баллов по шкале CHA2DS2-VASc =0 и женщин с суммой баллов =1, имеющим низкий риск инсульта/ТЭ (при условии отсутствии умеренного или тяжелого митрального стеноза, механических протезов клапанов сердца), антитромботическая терапия не показана.
Таблица 5
Шкала оценки риска инсульта CHA2DS2-VASc
Факторы риска тромбоэмболических осложнений | Оценка в баллах |
ХСН/дисфункция ЛЖ | 1 |
Артериальная гипертония | 1 |
Возраст 75 лет и старше | 2 |
Диабет | 1 |
Ишемический инсульт/транзиторная ишемическая атака/тромбоэмболия в анамнезе | 2 |
Сосудистое заболевание (инфаркт миокарда в анамнезе, атеросклеротическое поражение артерий нижних конечностей, атеросклеротическое поражение аорты) | 1 |
Возраст 65-74 года | 1 |
Женский пол | 1 |
Максимально возможное количество баллов | 9 |
Сокращения: ЛЖ — левый желудочек, ХСН — хроническая сердечная недостаточность.
Оценка риска кровотечений
Основной проблемой при длительной антитромботической терапии пациентов с ФП являются геморрагические осложнения. Необходимо оценить соотношение рисков инсульта и крупных кровотечений, особенно внутричерепных, являющихся наиболее опасными осложнениями антикоагулянтной терапии, способными вызвать инвалидность и даже смерть пациента.

При инициации антикоагулянтной терапии необходимо провести тщательное обследование пациента, направленное на выявление потенциальных источников кровотечений, определение модифицируемых и частично модифицируемых факторов риска кровотечения [69].
Первоочередной задачей является коррекция модифицируемых факторов риска кровотечений:
- достижение целевых уровней артериального давления;
- исключение необоснованного приема лекарств (прежде всего нестероидных противовоспалительных препаратов);
- исключение злоупотребления алкоголем [70];
- выбор антикоагулянта и его дозы;
- достижение стабильного международного нормализованного отношения (МНО) с пребыванием в терапевтическом диапазоне не менее 70% у пациентов, принимающих АВК;
- исключение опасных хобби/травмоопасных видов спорта;
- коррекция частично модифицируемых факторов риска кровотечений (лечение анемии, тромбоцитопении, коррекция нарушений функции почек и печени).
Наличие немодифицируемых факторов риска кровотечений, к которым относится возраст старше 65 лет, предшествующий инсульт или кровотечение, почечная патология, требующая диализа, либо трансплантация почки, цирроз печени, злокачественное новообразование, генетические факторы (полиморфизм гена CYP2C9), СД, когнитивное снижение/деменция, требует персонализированного подхода к выбору антикоагулянта, наиболее подходящего пациенту в соответствии с клиническими характеристиками (сопутствующие заболевания, риск инсульта, предпочтительный режим дозирования).
Для оценки риска кровотечений у пациентов с ФП используется шкала HAS-BLED (таблица 6).

Таблица 6
Индекс риска кровотечений HAS-BLEED
Клиническая характеристика | Баллы |
Гипертония — систолическое АД >160 мм рт.ст. | 1 |
Нарушение функции почек или печени: диализ, трансплантация почки или сывороточный креатинин ≥200 ммоль/л; хроническое заболевание печени (например, цирроз); или биохимические признаки серьезного поражения печени (например, уровень билирубина в 2 раза выше верхней границы нормы в сочетании с повышением активности АСТ/АЛТ/щелочной фосфатазы более чем в 3 раза по сравнению с верхней границей нормы и т.д.) | 1 или 2 |
Инсульт в анамнезе | 1 |
Кровотечение в анамнезе и/или предрасположенность к кровотечению, например, геморрагический диатез, анемия и т.д. | 1 |
Лабильное МНО — нестабильное/высокое МНО или <60٪ измерений МНО в пределах целевого диапазона | 1 |
Возраст старше 65 лет | 1 |
Сопутствующий прием антитромбоцитарных, нестероидных противовоспалительных препаратов или злоупотребление алкоголем | 1 или 2 |
Максимально возможное количество баллов | 9 |
Сокращения: АД — артериальное давление, АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, МНО — международное нормализованное отношение.
Сумма баллов по шкале HAS-BLED ≥3 указывает на повышенный риск кровотечений, но не означает, что нужно отказаться от антикоагулянтной терапии. Подобные пациенты требуют пристального контроля за потенциальными источниками и факторами риска кровотечений и более частого врачебного наблюдения.
У пациентов с ФП/ТП и механическими протезами клапанов сердца следует использовать только АВК (варфарин). Целевое МНО определяется типом протеза и его локализацией. При протезах митрального клапана целевое МНО должно быть не <2,5; аортального — не <2,0.

Во время длительной антитромботической терапии соотношение пользы и риска от назначения пероральных антикоагулянтов должны пересматриваться не реже 1 раза в год, также, как и необходимость продолжения лечения [74-75].
Классификация плановых инвазивных вмешательств по риску развития кровотечений представлена в Приложении 13 (таблица 13). Тактика лечения пациента определяется при участии врача-кардиолога и врача-хирурга и зависит от объема предполагаемого кровотечения.
Рекомендации по применению прямых пероральных антикоагулянтов для профилактики тромбоэмболических осложнений у пациентов с фибрилляцией предсердий
По сравнению с варфарином апиксабан, дабигатрана этексилат и ривароксабан обладают большим удобством применения, и не менее эффективны, чем варфарин в предупреждении инсульта и ТЭ.

При использовании ПОАК не требуется рутинный контроль показателей системы гемостаза (за исключением редких и сложных клинических случаев), эти препараты обладают меньшим числом взаимодействий с пищей и лекарственными средствами по сравнению с варфарином [17][76].

При назначении любого ПОАК рекомендуется предварительно оценить функцию почек (по величине клиренса креатинина). В дальнейшем клиренс креатинина на фоне терапии ПОАК следует определять как минимум ежегодно (пациентам с нарушенной функцией почек требуется более частый контроль).
С практической точки зрения наиболее удобен ривароксабан (прием 1 раз в сутки, простой алгоритм выбора дозы с учетом только клиренса креатинина), эффективность и безопасность которого изучена у пациентов, наиболее схожих по риску инсульта/ТЭ и кровотечений с российской популяцией больных с неклапанной ФП.

Антагонисты витамина К
Доказано, что АВК (варфарин) эффективно снижают риск развития инсульта. Однако их применение ограничено узким терапевтическим окном, что обусловливает необходимость частого мониторинга МНО и корректировку дозы препарата по его результатам [91-92].

Целевое значение МНО при ФП — 2,0-3,0 (в отдельных случаях, в частности, у пациентов с механическими протезами клапанов сердца требуется поддержание более высоких значений МНО) [93].
АВК являются эффективными и относительно безопасными препаратами, если значения МНО пребывают в терапевтическом диапазоне не менее 70% времени лечения [3].
Схемы подбора дозы варфарина и перехода от АВК на ПОАК представлены в Приложении 13 (таблица 12 и рисунок 4).
Другие антитромботические препараты
Рутинное сочетание антикоагулянтов c ингибиторами агрегации тромбоцитов не способствует улучшению профилактики инсульта/ТЭ и повышает риск кровотечений. Антиагреганты уступают по эффективности пероральным антикоагулянтам, не имеют преимущества по безопасности и поэтому не рекомендуются для профилактики инсульта/ТЭ у пациентов с ФП/ТП при отсутствии дополнительных показаний (первые 1-12 мес. после ОКС, чрескожных коронарных вмешательств, стентирования периферических артерий) [3].
Нефармакологические методы профилактики тромбоэмболии

Ушко левого предсердия считается основным (но не единственным) местом образования тромбов, которые могут приводить к ишемическому инсульту у пациентов с ФП. Хирургическая резекция или ушивание ушка левого предсердия часто выполняются (как сопутствующая процедура) во время операции на открытом сердце. Также разработаны малоинвазивные эпикардиальные и интервенционные транссептальные методики окклюзии отверстия ушка левого предсердия в целях снижения риска инсульта. Эти процедуры могут служить альтернативой пероральным антикоагулянтам у пациентов с ФП и высоким риском инсульта при наличии противопоказаний к длительному приему этих лекарственных средств. Решение о длительности и составе антитромботической терапии у пациентов с ФП, перенесших подобные вмешательства, должен принимать врач-кардиолог.
Приложение 7. Профилактика и реабилитация пациентов с фибрилляцией и трепетанием предсердий
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
Задачей врача-терапевта является контроль эффективности лечения, антикоагулянтной терапии, поддержание приверженности пациента к долгосрочной терапии и своевременное направление к врачу-специалисту при выявлении показаний.
Достижение контроля коморбидных заболеваний и коррекция модифицируемых факторов риска улучшает прогноз у пациентов с ФП и является одной из основных целей лечения. К контрольным показателям здоровья относятся снижение веса, отказ от алкоголя, стойкое поддержание целевых значений артериального давления, стойкая компенсация хронической СН (ХСН), достижение целевых значений холестерина липопротеидов низкой плотности у пациентов с сопутствующей ИБС, контроль гликемии у пациентов с СД и т.д. [2, 3, 94-97].
Наджелудочковые нарушения ритма сердца, как таковые, за редким исключением (ФП/ТП у пациентов с синдромом Вольфа-Паркинсона-Уайта) не относятся к угрожающим жизни аритмиям. Тем не менее они могут быть одним из первых проявлений клинически значимых заболеваний сердечно-сосудистой системы.

Большое значение имеет осознание пациентами важности ведения здорового образа жизни и модификации факторов риска возникновения и прогрессирования сердечно-сосудистых заболеваний (отказ от вредных привычек, поддержание умеренной физической активности, регулярное выполнение физических упражнений, контроль артериального давления при артериальной гипертонии, контроль уровня сахара крови при СД, поддержание нормальной массы тела, лечение апноэ сна, гормональных нарушений, коррекция уровня электролитов крови и др.).
Пациентам с любой формой ФП рекомендуются индивидуальные и групповые занятия лечебной физкультурой, в том числе с использованием тренажеров. Реабилитация на основе физических упражнений увеличивает физическую работоспособность, переносимость физических нагрузок, ФВ ЛЖ.
Пациентам с ФП рекомендовано:
- три или более еженедельных сеансов аэробной активности умеренной интенсивности, такой как ходьба, бег, езда на велосипеде, продолжительностью не менее 60 мин в течение не менее 3 мес.;
- дополнительно включать упражнения на растяжку и равновесие, тренировки с отягощением.
В целях профилактики сосудистых осложнений после процедуры катетерной аблации пациентам показано ограничение физических нагрузок в течение 1 нед. В случае отсутствия осложнений после вмешательства, проведения специальных реабилитационных мероприятий не требуется. В случаях возникновения любых осложнений после катетерной аблации, в т.ч. отсроченных, рекомендована скорейшая госпитализация в специализированный стационар.
В рамках диспансерных осмотров пациентов с ФП/ТП рекомендуется регулярно оценивать наличие и динамику фоновых заболеваний и факторов риска с целью снижения риска осложнений [98, 99].
При каждом врачебном осмотре рекомендуется оценивать соблюдение режима и адекватность антикоагулянтной терапии у всех пациентов с ФП с целью снижения риска тромбоэмболических осложнений, в том числе инсульта. Пациентам на терапии ПОАК рутинное определение МНО не рекомендовано, в динамике оцениваются факторы, влияющие на выбор препарата и дозы (клиренс креатинина, возраст, вес, прием лекарственных препаратов). Пациентам без факторов риска ТЭ по шкале CHA2DS2-VASc (0 баллов у мужчин, 1 балл у женщин), не получающим антикоагулянты, рекомендуется динамическая оценка баллов по шкале CHA2DS2-VASc, при выявлении дополнительных факторов риска — начало постоянной антикоагулянтной терапии [18, 100, 101].
Рекомендуется определять уровень креатинина крови и клиренса креатинина у всех пациентов с ФП не реже 1 раза в год [102-104]. Опираясь на значение клиренса креатинина, необходимо выбирать оптимальный ПОАК или корректировать его дозу.
С целью повышения приверженности к лечению рекомендовано индивидуальное консультирование пациента с ФП о его заболевании, методах и целях лечения [105, 106]. Адекватное восприятие пациентом своего заболевания и понимание необходимости ряда лечебных мероприятий могут улучшить течение болезни и результаты терапии.
Рекомендуется обучение всех пациентов с ФП алгоритмам действий при ухудшении состояния, в том числе информирование пациентов о первых симптомах инсульта и важности незамедлительного вызова врача при подозрении на инсульт или транзиторную ишемическую атаку.
Медицинские противопоказания для санаторно-курортного лечения и медицинской реабилитации с применением природных лечебных ресурсов10:
- Заболевания в острой и подострой стадии, в том числе острые инфекционные заболевания до окончания периода изоляции.
- Заболевания, передающиеся половым путем.
- Хронические заболевания в стадии обострения.
- Воспалительные полиартропатии, системные поражения соединительной ткани, анкилозирующий спондилит, другие уточненные спондилопатии высокой степени активности.
- Бактерионосительство инфекционных заболеваний.
- Заразные болезни глаз и кожи.
- Паразитарные заболевания.
- Заболевания, сопровождающиеся стойким болевым синдромом, требующим постоянного приема наркотических средств и психотропных веществ, включенных в списки II и III Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, зарегистрированных в качестве лекарственных препаратов.
- Туберкулез любой локализации в интенсивную фазу лечения при наличии бактериовыделения, подтвержденного бактериоскопическим, бактериологическим или молекулярно-генетическим методами;
- Новообразования неуточненного характера (при отсутствии письменного подтверждения в медицинской документации пациента о том, что пациент (законный представитель пациента) предупрежден о возможных рисках, связанных с осложнениями заболевания в связи с санаторно-курортным лечением).
- Злокачественные новообразования, требующие противоопухолевого лечения, в том числе проведения химиотерапии.
- Эпилепсия с текущими приступами, в том числе резистентная к проводимому лечению.
- Эпилепсия с ремиссией менее 6 мес. (для санаторно-курортных организаций не психоневрологического профиля).
- Психические расстройства и расстройства поведения в состоянии обострения или нестойкой ремиссии, в том числе представляющие опасность для пациента и окружающих.
- Психические расстройства и расстройства поведения, вызванные употреблением психоактивных веществ.
- Кахексия любого происхождения.
- Неизлечимые прогрессирующие заболевания и состояния, требующие оказания паллиативной медицинской помощи.
- Заболевания и состояния, определенные по результатам научных исследований природных лечебных ресурсов, в том числе с учетом результатов соответствующей многолетней практики.
Приложение 8. Фибрилляция и трепетание предсердий у особых категорий пациентов
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020
ФП/ТП у пациентов с артериальной гипертензией
Лечение АГ и тщательный контроль артериального давления рекомендован всем пациентам с ФП с целью профилактики рецидивов аритмии, ишемических и геморрагических осложнений.

Пациентам с диагностированной ФП и АГ рекомендовано назначение ингибиторов ангиотензинпревращающего фермента (иАПФ) или антагонистов ангиотензина II в сочетании с антиаритмической терапии с целью снижения вероятности рецидивов ФП.
Пациенты с сердечной недостаточностью
При ФП/ТП диагностика ХСН с сохранной ФВ ЛЖ затруднена в связи со сложностью дифференцирования симптомов, связанных с аритмией и собственно проявлениями СН, но в любом случае необходима коррекция АГ и ишемии миокарда.
Оценить признаки структурной патологии сердца на фоне симптомной ФП (гипертрофия ЛЖ и/или диастолическая дисфункция) позволяет ЭхоКГ. Снижение ранней диастолической скорости кровотока e’, зарегистрированное при помощи тканевого допплера, отражает нарушение расслабления ЛЖ, в то время как отношение Е/е’ коррелирует с инвазивным измерением давления наполнения ЛЖ.
Определение уровня предсердного натрийуретического пептида также применяется с целью диагностики ХСН с сохранной ФВ ЛЖ, но данный показатель имеет тенденцию к повышению на фоне ФП.
СН с промежуточным снижением ФВ ЛЖ — наличие симптомов и признаков СН, незначительного снижения ФВ ЛЖ до 40-49% и повышения уровня натрийуретических пептидов, а также одного из следующих критериев либо их сочетания: гипертрофии ЛЖ, увеличения левого предсердия, либо проявлений диастолической дисфункции.
При ФП/ТП диагностика затруднена, потому что на фоне аритмии возможна дилатация левого предсердия независимо от сопутствующей ХСН, также, как и повышение концентрации натрийуретических пептидов. Значения ФВ ЛЖ при ФП могут быть вариабельны, в то время как эхокардиографическая оценка затруднена в связи со снижением систолической функции ЛЖ на фоне аритмии и вариабельностью длины сердечного цикла.
Для профилактики развития ФП у пациентов с СН рекомендовано назначение иАПФ/ антагонистов ангиотензина II.

На фоне приема антагониста альдостерона — эплеренона, в качестве комплексной терапии иАПФ/ антагонистами ангиотензина II и бета-адреноблокаторами в ряде исследований наблюдалось снижение случаев развития ФП у пациентов с ФВ ЛЖ ≤35% и II ФК ХСН по классификации Нью-Йоркской ассоциации сердца (NYHA).
Симптоматическим пациентам с ФП и СН со сниженной ФВ ЛЖ для улучшения состояния и функции сердца рекомендовано выполнение абляции, при наличии вероятности развития тахикардиомиопатии.
ФП у пациентов пожилого и старческого возраста
Пациентам пожилого возраста с диагностированной ФП в связи с высоким риском тромбоэмболических осложнений рекомендовано назначение антикоагулянтной терапии. Возраст сам по себе не должен служить причиной отказа от лечения антикоагулянтами или уменьшения их дозы. При отсутствии противопоказаний ПОАК предпочтительны и у данной категории больных. При подборе антикоагулянтной терапии пациентам пожилого и старческого возраста надо учитывать возможное наличие когнитивных нарушений и проблем с глотанием. Для этой категории больных может быть наиболее удобным использование ривароксабана благодаря однократному приему и возможности приема измельченной таблетки вместе с пищей. Анализ результатов применения ривароксабана у пациентов 80 лет и старше указывает на сохранение основных преимуществ по безопасности перед АВК.
При отсутствии противопоказаний рекомендовано выполнение интервенционных вмешательств для лечения ФП/ТП.
При лечении пациентов пожилого и старческого возраста применяется комплексный подход к лечению ФП с индивидуальным подбором дозы препаратов и оценкой сопутствующей патологии.
Пациенты с острым коронарным синдромом
Пациентам с ОКС и ФП при тяжелом нарушении гемодинамики, рефрактерной к антиангинальной терапии или неадекватной частоте желудочковых сокращений на фоне медикаментозной терапии рекомендовано выполнение электроимпульсной терапии.
Для снижения частоты желудочкового ритма пациентам с ФП и ОКС рекомендовано внутривенное введение амиодарона или бета-адреноблокаторов.
С целью снижения частоты желудочкового ритма при отсутствии клинических признаков СН рекомендовано внутривенное введение селективных блокаторов кальциевых каналов с прямым влиянием на сердце (верапамил), при ФП и ОКС, сопровождающихся клиникой СН, — дигоксина.
Применение пропафенона у пациентов с ФП и ОКС не рекомендуется.
Пациенты с заболеваниями легких

Электроимпульсная терапия рекомендована пациентам с заболеваниями легких, если развившийся пароксизм ФП вызывает нарушение гемодинамики.
Пациентам с обструктивной болезнью легких для контроля частоты желудочкового ритма рекомендовано использование селективных блокаторов кальциевых каналов с прямым влиянием на сердце (верапамил/дилтиазем), либо в качестве альтернативы — применение селективных бета-адреноблокаторов. Назначение неселективных бета-адреноблокаторов, соталола и трифосаденина пациентами с обструктивной болезнью легких и ФП не рекомендуется. Пропафенон пациентам с обструктивной болезнью легких следует применять с осторожностью.
У всех пациентов с ФП рекомендовано исключить синдром обструктивного ночного апноэ. Aпноэ вызывает увеличение давления в предсердиях, их размера и изменение состояния вегетативной нервной системы. Своевременная коррекция факторов риска может улучшить отдаленные результаты лечения пациентов с ФП. С целью уменьшения частоты рецидивов ФП и улучшения контроля заболевания рекомендовано назначение оптимальной терапии, направленной на коррекцию обструктивного ночного апноэ.
Пациенты с сахарным диабетом
Для снижения риска тромбоэмболических осложнений и улучшения долгосрочного прогноза ФП рекомендована компенсация СД.
У пациентов с СД и ФП рекомендуется контролировать все сердечно-сосудистые факторы риска, включая АД и уровень липидов крови.
Пациенты с гипертиреозом
Пациентам с ФП и активным заболеванием щитовидной железы с учетом наличия других факторов риска инсульта рекомендуется антитромботическая терапия.
Для контроля частоты желудочкового ритма пациентам с ФП на фоне тиреотоксикоза рекомендуется применение бета-адреноблокаторов, при отсутствии противопоказаний. Если применение бета-адреноблокатора невозможно, рекомендуется назначение селективных блокаторов кальциевых каналов с прямым влиянием на сердце: дилтиазема или верапамила.
При выборе стратегии контроля ритма сердца, перед кардиоверсией рекомендовано нормализовать функцию щитовидной железы, в противном случае велика вероятность рецидива аритмии.
Пациенты с заболеваниями почек
ХБП предрасполагает к развитию ФП, а наличие ФП сопряжено с ухудшением внутрипочечной гемодинамики, риском дальнейшего снижения скорости клубочковой фильтрации и нарастания альбуминурии. По сравнению с пациентами только с наличием ФП или ХБП, у пациентов с их сочетанием имеется повышенный риск инсульта и смерти из-за высокого риска развития как тромбоэмболических осложнений, так и тяжелых кровотечений.

При назначении ААП рекомендована коррекция дозы препарата, исходя из уровня скорости клубочковой фильтрации с учетом потенциального удлинения времени полувыведения вещества. Дозы препаратов при лечении ФП/ТП и ХБП должны соответствовать инструкциям. В таблицах 7 и 8 представлена характеристика ААП для поддержания СР и контроля частоты желудочковых сокращений при ФП и ХБП.
Пациенты без четких показаний к контролю ритма по умолчанию должны придерживаться стратегии контроля частоты. При этом следует учитывать вариативность симптоматики и потенциально повышенную склонность к развитию тахи-индуцированной кардиомиопатии, фармакокинетику и диализуемость препаратов, применяемых для контроля частоты.
Таблица 7
Характеристика антиаритмических препаратов для поддержания сердечного ритма при фибрилляции и трепетании предсердий и хронической болезни почек
Препарат | Элиминация | Диализируемость | Дозирование при ХБП | Примечания |
Пропафенон | 38-50٪ выводится с мочой в виде активных метаболитов (1٪ без изменений) | нет | рекомендуется тщательный мониторинг (госпитализация при прогрессирующей ХБП) | не использовать при наличии значимого структурного заболевания сердца |
Амиодарон | нет почечной элиминации | нет | нет требований к дозировке; взаимодействие со многими препаратами | |
Соталол | 70٪ из организма без изменений в моче | назначить поддерживающую дозу после гемодиализа или добавить 80 мг после гемодиализа | относительное противопоказание с учетом риска проаритмических эффектов; в редких и отдельных случаях доза должна быть уменьшена вдвое или уменьшена до четверти при ХБП | относительное противопоказание ввиду риска проаритмических эффектов |
Сокращение: ХБП — хроническая болезнь почек.
Таблица 8
Характеристика антиаритмических препаратов для контроля частоты ритма сердца при хронической болезни почек
Препарат | Элиминация | Диализируемость | Дозирование при ХБП |
Атенолол | без изменений в моче | да | может потребоваться уменьшение дозы |
Пропранолол | печеночный метаболизм | нет | креатинин сыворотки может увеличиваться, |
Бисопролол | 50٪ из организма без изменений в моче | нет | доза должна быть уменьшена при тяжелой ХБП |
Метопролол | печеночный метаболизм | да | снижение дозы не требуется |
Карведилол | 16٪ почечным путем | нет | конкретные рекомендации по корректировке дозы при почечной недостаточности отсутствуют |
Верапамил | 70٪ выводится с мочой | нет | снижение дозы на 20-25٪, если клиренс креатинина менее 10 мл/мин, не очищается гемодиализом |
Дилтиазем | 2-4٪ неизмененного препарата выводится с мочой | нет | использовать с осторожностью |
Дигоксин | основной путь элиминации — почечный (тесно коррелирующий с СКФ) | нет | требуется адаптация дозировки, мониторинг уровня дигоксина сыворотки крови |
Сокращение: СКФ — скорость клубочковой фильтрации, ХБП — хроническая болезнь почек.
Взрослые пациенты с врожденными пороками сердца
Закрытие дефектов межпредсердной перегородки рекомендовано в возрасте до 40 лет с целью снижения риска возникновения ФП/ТП.
У пациентов с симптомными предсердными тахиаритмиями в анамнезе и показаниями к хирургической коррекции дефекта межпредсердной перегородки рекомендуется оценить возможность абляции ФП во время хирургического лечения порока.
Целесообразность хирургического лечения ФП (операция "лабиринт") рекомендовано оценить у пациентов с симптомной ФП, которым планируется хирургическая коррекция врожденного порока сердца (ВПС).
Назначение антикоагулянтной терапии рекомендовано всем взрослым пациентам с ФП/ТП или предсердными тахикардиями после шунтирующих операций при ВПС, при наличии цианоза, после паллиативной операции Фонтена или при системном правом желудочке. При остальных ВПС антикоагулянтная терапия назначается при количестве баллов по шкале CHA2DS2-VASc ≥1.
Пациенты с клапанными пороками сердца
Раннее хирургическое лечение рекомендуется при тяжелой недостаточности митрального клапана, сохранной функции ЛЖ и впервые возникшей ФП даже при отсутствии симптомов, особенно если выполнение хирургической операции представляется эффективным.
Бессимптомным пациентам с тяжелым митральным стенозом, соответствующей анатомией клапана и впервые возникшей ФП рекомендованы ранняя митральная вальвулотомия или протезирование.
Фибрилляция предсердий у спортсменов
Длительные интенсивные физические тренировки могут способствовать возникновению ФП/ТП.
Для профилактики рецидивов ФП у спортсменов рекомендовано выполнение абляции. Катетерная абляция не рассматривается в качестве метода, увеличивающего продолжительность жизни или снижающего риск инсульта, но при этом может значимо улучшать качество жизни.
После приема таблетированных ААП (пропафенона), пациентам рекомендовано воздерживаться от спортивных нагрузок на время, пока сохраняется ФП и далее до двух периодов полураспада ААП (для пропафенона — 20 ч).
Тактика ведения беременных с фибрилляцией предсердий
Если риск осложнений на фоне продолжающегося приступа ФП считается высоким для матери и плода, на всех этапах беременности пациентам с гемодинамически значимой ФП рекомендовано проведение электрической кардиоверсии.
Антикоагулянтная терапия рекомендована беременным женщинам с ФП при наличии высокого риска развития инсульта. Для минимизации тератогенного риска и внутриутробного кровотечения в первом триместре и в течение 2-4 нед. до родоразрешения рекомендуется назначение гепарина и его производных с индивидуальным подбором дозы. В остальное время в период беременности могут быть использованы АВК или гепарин и его производные (эноксапарин натрия считается безопасным, так как не проникает через плаценту). В третьем триместре беременности рекомендуется частый лабораторный контроль коагуляционного статуса (каждые 10-14 дней) и соответствующая корректировка дозы препарата.
Беременные женщины с механическими протезами клапанов сердца и ФП, которые решили прекратить терапию АВK по согласованию с лечащим врачом, в течение 6-12 нед. гестации должны непрерывно получать гепарин или эноксапарина натрия с индивидуальным подбором дозы препарата (подбирается под контролем фактора активности анти-Ха).
Назначение ПОАК в период беременности, а также во время ее планирования не рекомендовано.
Приложение 9. Алгоритм принятия решений при выборе стратегии "контроль
ритма".
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.

Сокращения: АВК — антагонисты витамина К, ЛП — левое предсердие, ПОАК — прямые пероральные антикоагулянты, ФП — фибрилляция предсердий, ЧПЭхоКГ — чреспищеводная эхокардиография, ЧСС — частота сердечных сокращений.
Приложение 10. Выбор препарата для контроля ритма при пароксизме ФП.
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020
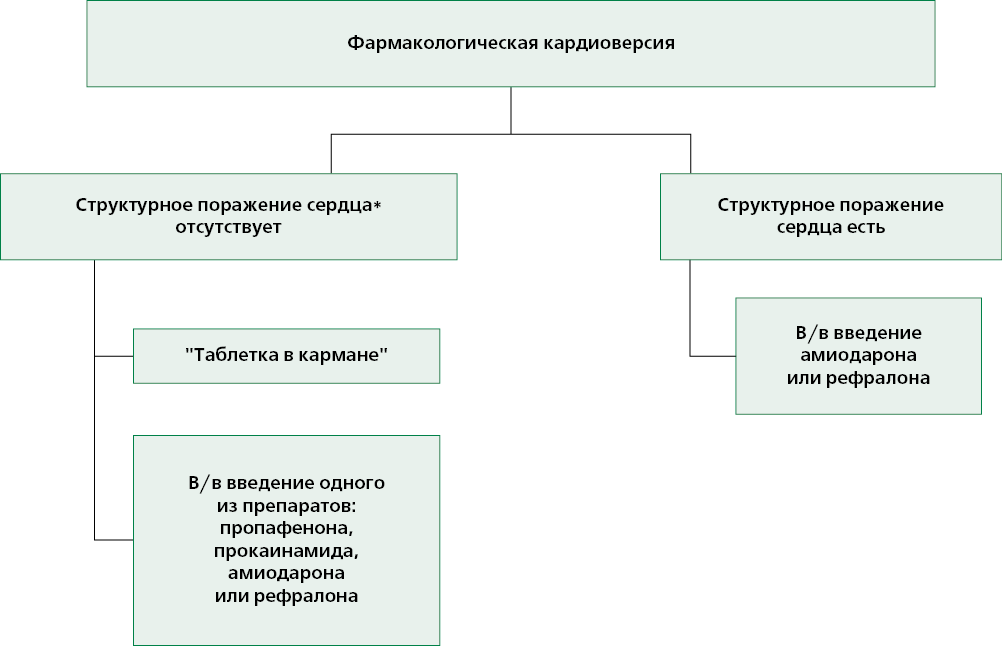
Примечание: * — структурным поражением сердца следует считать: постинфарктный кардиосклероз; сниженную систолическую функцию ЛЖ (ФВ ЛЖ 40٪ и менее) с любыми проявлениями СН; гипертрофию миокарда ЛЖ, превышающую 14 мм по данным ЭхоКГ.
Сокращение: в/в — внутривенное.
Приложение 11. Характеристика антиаритмических препаратов [1][2].
Таблица 9
Рекомендации по выбору антиаритмического препарата для поддержания сердечного ритма
Лекарственный препарат | Рекомендации по применению |
β-адреноблокаторы | У пациентов без структурных заболеваний сердца для профилактики рецидивов ФП, особенно когда аритмия четко связана с психическим или физическим напряжением |
Препараты IC класса (пропафенон, лаппаконитин гидробромид, диэтиламин-пропионил-этоксикарбонил-аминофенотиазин, флекаинид) | У пациентов без выраженной структурной патологии сердца, с целью минимизации риска развития угрожающих жизни желудочковых аритмий. С целью профилактики трансформации ФП в ТП с высокой проводимостью во время приёма ААП I класса рекомендовано сочетание с β-блокаторами |
Препараты III класса (амиодарон, соталол) | Амиодарон* У пациентов со структурным заболеванием сердца и у пациентов со сниженной функцией левого желудочка (ФВ ЛЖ <40٪). У пациентов с СН или гипертрофией миокарда ЛЖ (≥14 мм) для профилактики рецидивирующей симптоматической ФП. Амиодарон имеет бо́льшую эффективность в сравнении с соталолом или пропафеноном, для профилактики рецидивов ФП. Однако его долгосрочное применение ассоциировано с развитием экстракардиальных побочных эффектов, что делает амиодарон препаратом второй линии у пациентов, которым подходят другие антиаритмические препараты |
Соталол Соталол по эффективности уступает амиодарону. Наиболее оправдано его применение у пациентов со стабильной ИБС. Соталол рекомендован для профилактики рецидивов ФП у пациентов без тяжелого органического поражения сердца, без угнетения насосной функции и СН. У пациентов с ФП, принимающих соталол, рекомендуется тщательный мониторинг интервала QT, уровня калия в сыворотке крови, клиренса креатинина и других факторов риска проаритмических осложнений |
Примечание: * — амиодарон (ААП III класса) содержит в своем составе 37٪ йода. Лечение амиодароном связано с изменениями показателей функции щитовидной железы, а также с дисфункцией щитовидной железы (гипотиреоз, вызванный амиодароном тиреотоксикоз, индуцированный амиодароном). Среди других возможных побочных эффектов во время применения амиодарона выделяют: пневмониты, пневмосклероз, фиброз (амиодароновое лёгкое), развитие фотосенсибилизация (бронзовая кожа), а также зрительную дисфункцию, связанную с микроотложениями промеланина и липофусцина в эпителии роговицы (окрашивание роговицы в голубой цвет), двоение в глазах, зуд, сухость глаз.
Всем пациентам перед назначением амиодорона целесообразно выполнение рентгенологического исследования легких и оценки уровня тиреотропного гормона и гормонов щитовидной железы (Т4 свободный). На фоне постоянной терапии показано ежегодное рентгенологическое исследование легких, 1 раз в 6 месяцев исследование функции внешнего дыхания, содержания Т4 свободного и тиреотропного гормона.
С целью профилактики развития фотосенсибилизации рекомендуется избегать пребывания на солнце или пользоваться специальными солнцезащитными средствами. Ежегодный осмотр окулиста необходим с целью выявления значительных отложений в роговице либо развития нарушений зрения.
Сокращения: ААП — антиаритмические препараты, ИБС — ишемическая болезнь сердца, ЛЖ — левый желудочек, СН — сердечная недостаточность, ТП — трепетание предсердий, ФВ — фракция выброса, ФП — фибрилляция предсердий.
Таблица 10
Дозировки и схемы применения препаратов при фибрилляции
и трепетании предсердий при пероральном приеме
Препарат | Дозы и схемы назначения | Частые побочные эффекты | Противопоказания |
Препарат | Дозы и схемы назначения | Частые побочные эффекты | Противопоказания |
Бета-адреноблокаторы (II) (контроль частоты СР) | Кардиальные: брадикардия, гипотензия, АВ-блокада, усугубление ХСН. Некардиальные: головокружение, усталость, бронхообструктивный синдром, тревожные расстройства, депрессия, диарея, сексуальные расстройства, гипогликемия при инсулинозависимом СД | — СА-блокада II-IIIст., — АВ-блокада II-III ст., — синусовая брадикардия (при отсутствии имплантированного ЭКС), — артериальная гипотония, — ХСН IV ФК, — бронхообструктивный синдром | |
Атенолол | 25-100 мг 1 раз в сутки | ||
Бисопролол | 1,25-20 мг в сутки в 1-2 приема (максимальная суточная доза 20 мг) | ||
Карведилол | 3,125-50 мг 1-2 раза в сутки | ||
Метопролол | 100-200 мг в сутки (кратность приема в зависимости от формы препарата) | ||
Небиволол | 2,5-10 мг 1 раз в сутки или разделить дозу | ||
Пропранолол | 10-40 мг 3 раза в сутки | ||
Блокаторы кальциевых каналов (IV) (контроль частоты СР) | Кардиальные: гипотензия, отеки, АВ-блокада, синусовая брадикардия, усугубление ХСН у пациентов со сниженной ФВ ЛЖ. Некардиальные: головная боль, сыпь, гиперплазия десен, запор, диспепсия | — СА-блокада II-IIIст., — АВ-блокада II-III ст., — синусовая брадикардия (при отсутствии имплантированного ЭКС), — ХСН, снижение ФВ ЛЖ, — ФП/ТП у пациентов с синдромом ВПУ | |
Верапамил | 40-120 мг 3 раза в сутки (120-480 мг при пролонгированной форме 1 раз в сутки) | ||
Дилтиазем | 60 мг 3 раза в сутки до общей дозировки 360 мг (120-360 мг при пролонгированной форме 1 раз в сутки) | ||
Препараты IC класса (поддержание СР) | Кардиальные: СА-блокада, АВ-блокада, расширение комплекса QRS до 25٪, отрицательный инотропный эффект, усугубление ХСН, увеличение порогов стимуляции и дефибрилляции сердца. Аритмогенное действие — мономорфная желудочковая тахикардия, фибрилляция желудочков. Некардиальные: головокружение, утомляемость, сухость во рту, тошнота, диарея, тремор, нечеткость зрения, нарушения функции печени | — СА-блокада II-III ст., — АВ-блокада II-III ст., — синусовая брадикардия (при отсутствии имплантированного ЭКС), — тяжелые нарушения внутрижелудочкового проведения (QRS >140 мс), — ТП (при отсутствии терапии препаратами, блокирующими АВ проведение), — ИБС, ПИКС, ХСН любого ф.кл., — снижение ФВ ЛЖ, — болезни клапанного аппарата сердца с нарушением гемодинамики, — синдром Бругада, — наследственный синдром удлиненного интервала QT | |
Пропафенон | 150 мг 3-4 раза в сутки (максимальная суточная доза — 900 мг в 3 приема) | ||
Лаппаконитина гидробромид | 25-50 мг 3 раза в сутки | ||
Диэтиламинопропионилэток-сикарбониламино-фенотиазин | 50 мг 2-3 раза в сутки | ||
Флекаинид | 100-200 мг в сутки (максимальная суточная доза — 300-400 мг). Пациентам пожилого возраста — 50 мг 2 раза в сутки (максимальная суточная доза — 150 мг 2 раза в сутки) | Кардиальные: проаритмогенное действие, (наиболее вероятна у пациентов со структурным заболеванием сердца и/или значительным нарушением функции ЛЖ). Некардиальные: головокружение, нарушения зрения, одышка, астения, утомляемость, пирексия, отеки | — бессимптомные или нежизнеугрожающие желудочковые аритмии; — кардиогенный шок, — СН, острый ИМ, ИМ в анамнезе, — тяжелая артериальная гипотензия; — выраженная брадикардия — СССУ или синдром брадикардии-тахикардии (если не имплантирован ЭКС), — АВ-блокада II-III ст., |
— СА-блокада (при отсутствии имплантированного ЭКС), — блокады ножек пучка Гиса или дистальные нарушения внутрижелудочковой проводимости, — длительно сохраняющаяся ФП пациентов, у которых не было попыток восстановить синусовый ритм, синдром Бругада, — гемодинамически значимый клапанный порок сердца, — одновременное применение антиаритмических препаратов класса I, — значительные электролитные нарушения | |||
Препараты III класса | Кардиальные: гипотензия, брадикардия, АВ-блокада, веретенообразная желудочковая тахикардия, возрастание порога дефибрилляции Некардиальные: кератопатия, гипо- и гипертиреоз, рвота, запор, фотосенсибилизация, атаксия, головокружение, периферическая нейропатия, тремор, лекарственный гепатит, цирроз печени, фиброз легких, пневмонит | — QT >480 мс до начала терапии, — ХСН III-IV ФК., — синусовая брадикардия, — СА-блокада II-III ст., — АВ-блокада II-III ст. | |
Амиодарон (контроль частоты СР, поддержание СР) | 600 мг в сутки 4 недели, 400 мг в сутки 4 недели, затем поддерживающая доза 200 мг 1 раз в сутки | ||
Соталол (поддержание СР) | 80-160 мг 2 раза в сутки, максимальная доза 320 мг в сутки | Кардиальные: брадикардия, гипотензия, усугубление ХСН, веретенообразная ЖТ. Некардиальные: головокружение, усталость, бронхообструктивный синдром, тревожные расстройства, депрессия, диарея, сексуальные расстройства, гипогликемия при инсулинозависимом СД | — СА-блокада II-III ст., — АВ-блокада II-III ст., — синусовая брадикардия (при отсутствии имплантированного ЭКС), артериальная гипотония, — ХСН III-IV ФК, — патологическая ГЛЖ (>14 мм), — острый период ИМ, — бронхообструктивный синдром |
Сердечные гликозиды (контроль частоты СР) | |||
Дигоксин | 0,125-0,5 мг 1 раз в сутки | ||
Сокращения: АВ — атриовентрикулярная (блокада), ВПУ — синдром преждевременного возбуждения желудочков Вольфа-Паркинсона-Уайта, ГЛЖ — гипертрофия левого желудочка, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ЖТ — желудочковая тахикардия, ЛЖ — левый желудочек, ПИКС — постинфарктный кардиосклероз, СА — синоартериальная, СД — сахарный диабет, СН — сердечная недостаточность, СР — сердечный ритм, СССУ — синдром слабости синусового узла, ТП — трепетание предсердий, ФВ — фракция выброса, ФК — функциональный класс, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ЭКС — электрокардиостимулятор.
Приложение 12. Тактика профилактики пароксизмов ФП
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
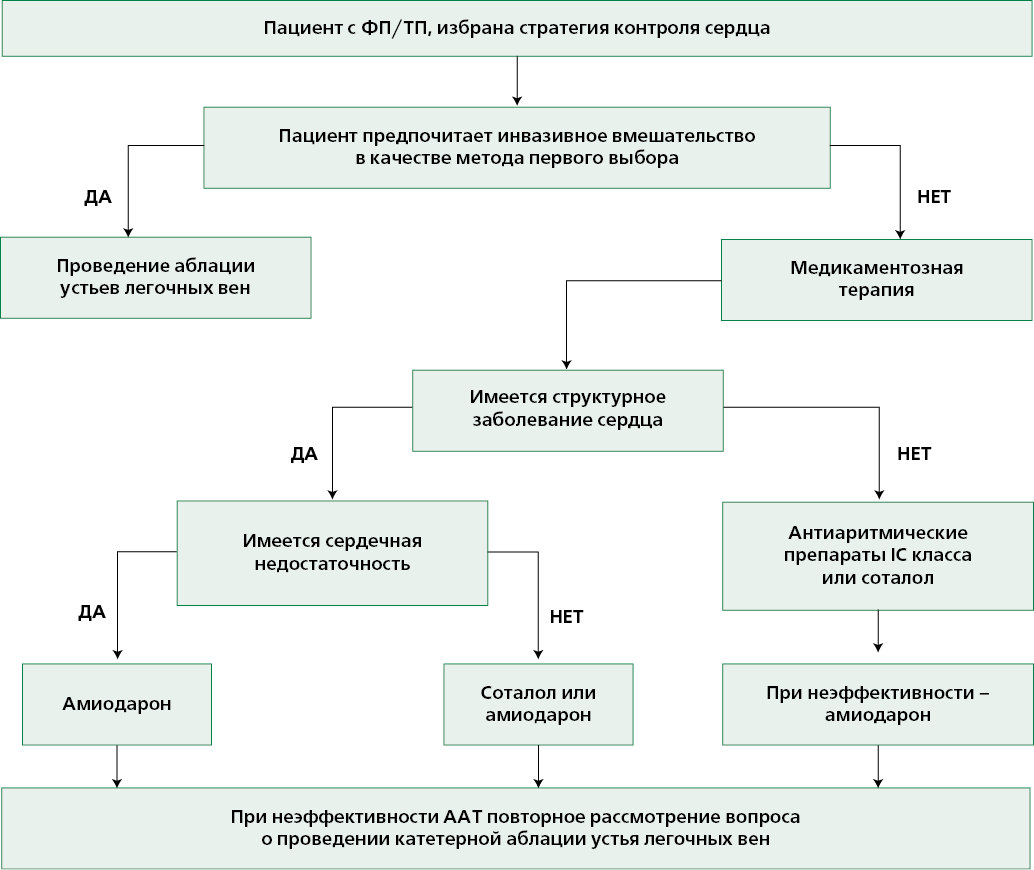
Сокращения: ААТ — антиаритмическая терапия, ТП — трепетание предсердий, ФП — фибрилляция предсердий.
Приложение 13. Принципы антикоагулянтной терапии
Адаптировано из клинических рекомендаций ЕОК по лечению фибрилляции предсердий, 2024; клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
Таблица 11
Критерии выбора дозы прямых пероральных антикоагулянтов
Наименование препарата | Стандартная доза | Сниженная доза | Критерии для снижения дозы | Противопоказания |
Дабигатрана этексилат | 150 мг | 110 мг 2 р/д | Возраст ≥80 лет; Одновременный прием верапамила; По усмотрению врача: возраст 75-80 лет; повышенный риск кровотечений; заболевания верхних отделов желудочно-кишечного тракта (гастрит, эзофагит, желудочно-кишечный рефлюкс); клиренс креатинина* 30-50 мл/мин | клиренс креатинина* <30 мл/мин; умеренный или тяжелый митральный стеноз; механические протезы клапанов сердца; антифосфолипидный синдром |
Ривароксабан** | 20 мг 1 р/д | 15 мг 1 р/д | Клиренс креатинина* 15-49 мл/мин | клиренс креатинина* <15 мл/мин; умеренный или тяжелый митральный стеноз; механические протезы клапанов сердца; антифосфолипидный синдром |
Апиксабан | 5 мг 2 р/д | 2,5 мг 2 р/д | Наличие 2-х и более факторов: возраст ≥80 лет; масса тела ≤60 кг; креатинин ≥133 мкмоль/л |
Примечание: * — определение клиренса кретинина по формуле Кокрофта-Голта; ** — при затрудненном глотании таблетка ривароксабана может быть измельчена и смешана с водой и жидким питанием.
Таблица 12
Схема подбора дозы варфарина
Дни лечения варфарином | МНО (определение в 9-11 ч.) | Суточная доза варфарина (прием вечером) |
Первые 2-3 дня — 2 таблетки (5 мг) однократно в одно и то же время | ||
3-4 день | <1,5 | ↑ дозу на 0,625 мг |
1,5-1,9 | доза прежняя | |
2-3 | доза прежняя | |
3-4 | ↓ дозу на 0,625 мг | |
>4 | пропустить прием 1 дозы, затем ↓ дозу на 1,25 мг | |
5-6 день | <1,5 | ↑ дозу на 0,625 мг |
1,5-1,9 | доза прежняя | |
2-3 | доза прежняя | |
3-4 | ↓ суточную дозу на 0,625 мг | |
>3 | пропустить приём 1 дозы, затем ↓ дозу на 1,25 мг | |
Примечание: 7-й, 9-й дни и т.д. — алгоритм соответствует дням 3-й и 5-й.
Доза считается подобранной, если дважды МНО остается в диапазоне 2,0-3,0 и значения МНО отличаются не более чем на 0,3.
Сокращение: МНО — международное нормализованное отношение.
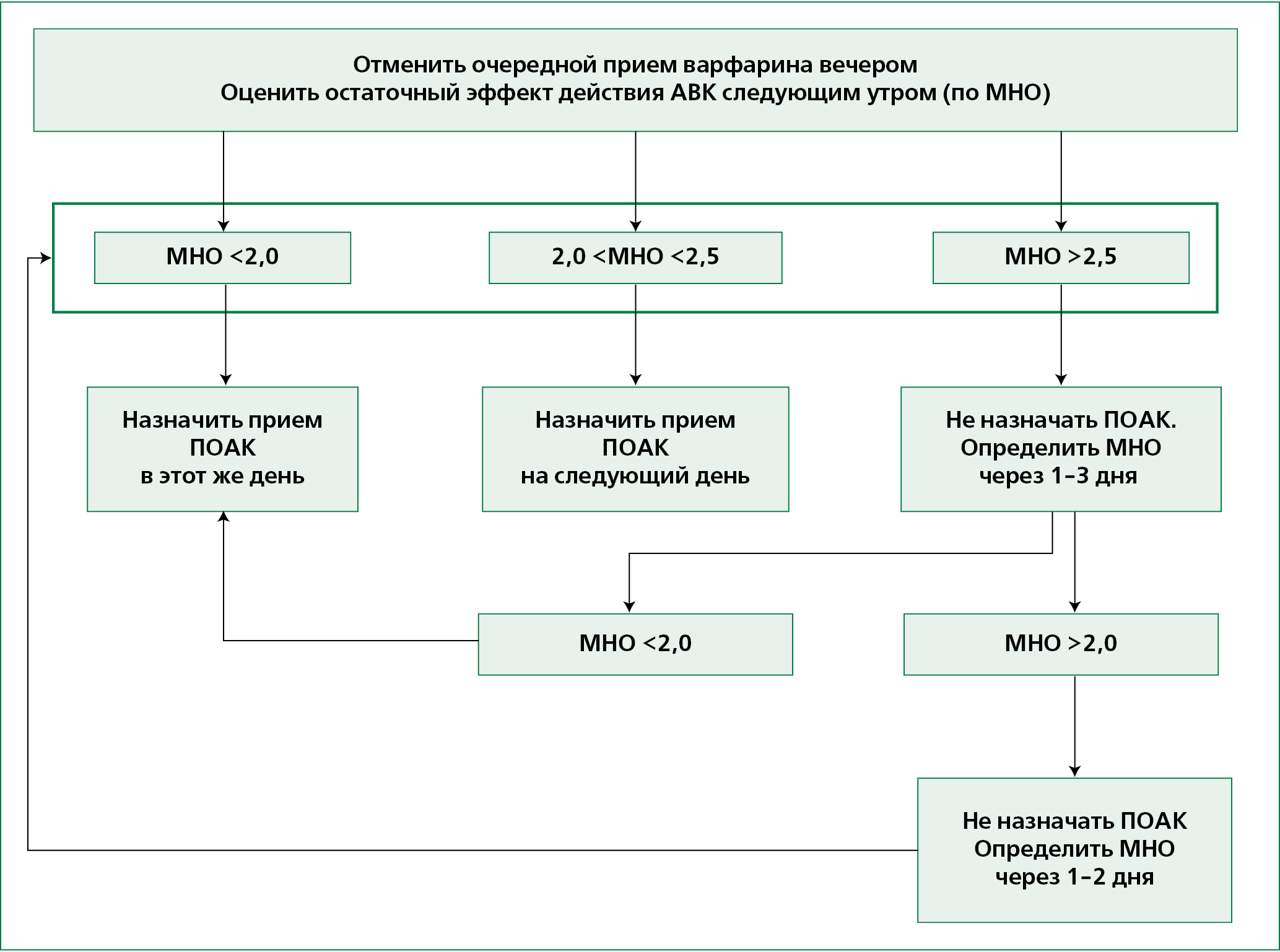
Рис. 4. Схема перехода от АВК на ПОАК.
Сокращения: АВК — антагонисты витамина К, МНО — международное нормализованное отношение, ПОАК — прямые пероральные антикоагулянты.
Таблица 13
Классификация плановых инвазивных вмешательств по риску развития кровотечений
Степень риска кровотечения | Вид вмешательства |
Минимальный риск | Стоматологические процедуры: — удаление 1-3 зубов — вмешательства по поводу пародонта — вскрытие абсцесса — установка импланта |
Операции по поводу катаракты и глаукомы | |
Эндоскопические исследования без биопсии и резекции | |
Поверхностные вмешательства: — вскрытие абсцесса — удаление небольших образований кожи и т.д. | |
Низкий риск* | Эндоскопические исследования с биопсией |
Биопсия мочевого пузыря или простаты | |
Электрофизиологическое исследование или катетерная аблация (кроме некоторых сложных процедур, см. ниже) | |
Ангиография (не коронарных артерий) | |
Имплантация ЭКС или кардиовертера-дефибриллятора (кроме технически сложных процедур, например при врожденных пороках сердца) | |
Высокий риск* | Сложное эндоскопическое исследование с дополнительным вмешательством (полипэктомия, сфинктерэктомия и т.п.) |
Спинальная или эпидуральная анестезия, люмбальная пункция | |
Торакальная хирургия | |
Абдоминальная хирургия | |
Большие ортопедические операции | |
Биопсия печени | |
Трансуретральная резекция простаты | |
Биопсия почек | |
Экстракорпоральная ударноволновая литотрипсия | |
Высокий риск в сочетании с повышенным риском тромбоэмболии | Сложная катетерная аблация в левых полостях сердца (изоляция устьев легочных вен, некоторые виды аблации по поводу желудочковой тахикардии) |
Примечание: * — низкий риск кровотечений — редко возникают и/ или имеют малую клиническую значимость; высокий риск — обусловлен большой частотой или клинической значимостью кровотечений.
Приложение 14. Шкала приверженности Национального общества доказательной фармакотерапии (НОДФ). Опросник для оценки приверженности лекарственной терапии "Общая фактическая приверженность" (модифицированный вариант) [107]
1. Нарушаете ли Вы рекомендации Вашего лечащего врача в отношении приема лекарственных препаратов (регулярности приема, соблюдения дозировки препарата, кратности и времени приема лекарственного средства и т.д.)? | ||
☐ | 1) Да, я не стал принимать назначенные препараты | 4 балла |
☐ | 2) Да, я прекратил начатый прием препаратов | 3 балла |
☐ | 3) Да, я принимаю лекарство нерегулярно, самостоятельно прекращаю прием лекарства или меняю дозу, кратность, время приема препаратов | 2 балла |
☐ | 4) Да, я иногда забываю принять препараты | 1 балл |
☐ | 5) Нет, я принимаю лекарства строго согласно рекомендациям врача | 0 баллов |
2. Если Вы не стали принимать или прекратили прием назначенных лекарственных препаратов, назовите ведущую причину этого (можно выбрать только один ответ) | ||
☐ | 1) Забываю принять препараты | |
☐ | 2) Опасаюсь побочных эффектов, вреда здоровью при длительном приеме лекарств | |
☐ | 3) Возникли побочные эффекты лекарственной терапии | |
☐ | 4) Отсутствие ощутимого эффекта (улучшения) от лечения | |
☐ | 5) Принимаю очень много разных лекарственных препаратов | |
☐ | 6) У меня очень сложная схема приема лекарств (много раз в день, помногу таблеток) | |
7) Высокая цена препаратов | ||
☐ | 8) Сомневаюсь в необходимости назначенного мне лечения | |
☐ | 9) Не хочу принимать лекарства постоянно, длительно | |
☐ | 10) Другое (укажите) | |
Ключ к шкале приверженности*
0 баллов — полная приверженность;
1 балл — частичная, неполная приверженность, ненамеренные нарушения врачебных рекомендаций;
2 балла — частичная, неполная приверженность, намеренные нарушения врачебных рекомендаций;
3 балла — частичная, вторичная неприверженность;
4 балла — полная, первичная неприверженность.
Примечание: * — в экземплярах Шкалы приверженности, выдаваемых пациентам для заполнения, не следует оставлять ключ к опроснику, чтобы пациент не видел возможных результатов опроса.
Приложение 15. Правила действий при утяжелении клинического течения и осложнениях ФП/ТП. Показания для госпитализации
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
Действия врача-терапевта при утяжелении клинического течения, возникновении осложнений ФП/ТП:
- Определение причины утяжеления клинического состояния (недостаточный контроль сердечного ритма или ЧСС, возникновение новых аритмий, тромбоэмболические осложнения, кровотечение, возникновение или прогрессирование СН, возникновение или утяжеление интеркуррентных заболеваний);
- определение целесообразности и срочности восстановления СР у пациентов с пароксизмом ФП;
- коррекция терапии в соответствии с характером и тяжестью дополнительных расстройств;
- определение целесообразности, профиля и срочности госпитализации и/или консультации специалистов.
- Проведение лабораторно-инструментальных исследований:
- ЭКГ (по необходимости);
- ЭхоКГ (по необходимости);
- развернутый клинический анализа крови (по необходимости);
- биохимический анализ крови с определением МНО (у пациентов, получающих АВК), клиренса креатинина/расчетной скорости клубочковой фильтрации, аланинаминотрансферазы, аланинаминотрансферазы, билирубина, концентрации электролитов (при необходимости);
- Направление на консультацию к врачам-специалистам (врач-кардиолог и др.).
Показания для консультации врача-кардиолога:
- невозможность достижения целей профилактики и лечения с использованием подходов, рекомендуемых для широкого применения при ФП/ТП;
- ограничения или осложнения, препятствующие применению или серьезно снижающие эффективность подходов к профилактике и лечению, рекомендуемых для широкого применения при ФП/ТП;
- особая тяжесть клинических проявлений ФП/ТП, сопутствующих заболеваний или факторов риска, способствующих возникновению и прогрессированию заболевания.
Показания для плановой госпитализации:
- Выполнение кардиоверсии при наличии показаний
- перед госпитализацией при наличии риска тромбоэмболических осложнений по шкале CHA2DS2-VASc 2 балла и выше пациент должен принимать антикоагулянты не менее 3 нед.;
- при низком риске тромбоэмболических осложнений (CHA2DS2-VASc 0 баллов у мужчин или 1 балл у женщин) прием антикоагулянтной терапии перед госпитализацией не обязателен;
- запланированное выполнение в стационаре чреспищеводной ЭхоКГ или компьютерной томографии ушка левого предсердия для исключения тромбоза левого предсердия перед кардиоверсией;
- Подбор ритмурежающей терапии
- наличие тахисистолии должно быть зарегистрировано на ЭКГ в покое или при ХМ ЭКГ;
- Коррекция антиаритмической терапии;
- Нарастание СН при ФП;
- Постановка электрокардиостимулятора;
- Выполнение интервенционных и хирургических процедур.
Показания для экстренной госпитализации:
- ФП/ТП с нарушением гемодинамики (пресинкопальные или синкопальные состояния, гипотония, признаки ишемии миокарда) вне зависимости от давности пароксизма и формы ФП и/или ФП с частым желудочковым ответом (>180 в мин);
- Пароксизм ФП сроком до 48 ч при неэффективной попытке медикаментозной кардиоверсии или противопоказаниях к медикаментозной кардиоверсии.
В случаях, когда восстановление ритма не показано (например, при выявленных ранее малосимптомных пароксизмах ФП, не влияющих на гемодинамику, и подобранной антикоагулянтной терапии) госпитализация не требуется.
При наличии показаний, нестабильной гемодинамике, а также при наличии тахисистолии желудочков и предшествующем приеме антикоагулянтов или приступе ФП длительностью до 48 ч, восстановление ритма или ритмурежающая терапия может проводиться бригадой скорой медицинской помощи на догоспитальном этапе.
Приложение 16. Информация для пациента
Адаптировано из клинических рекомендаций Минздрава России "Фибрилляция и трепетание предсердий у взрослых", 2020.
У Вас диагностирована фибрилляция предсердий. Это заболевание связано с прекращением синхронного сокращения предсердий, в результате чего нарушается нормальная работа сердца и в предсердиях могут образоваться тромбы, которые иногда мигрируют с током крови по артериям, вызывая инсульт и закупорку сосудов в других органах.
Неравномерные (и иногда слишком частые) сокращения сердца могут приводить к нарушению работы сердца как насоса, из-за чего возможно появление сердечной недостаточности, которая проявляется одышкой при физической нагрузке и накоплением жидкости в организме. Бывают и другие неблагоприятные последствия фибрилляции предсердий.
Фибрилляция предсердий бывает постоянная и приступообразная. При постоянной форме фибрилляции предсердий она будет сохраняться все время и основные усилия врачей будут направлены на то, чтобы пульс не был слишком частым.
Если болезнь протекает приступообразно, будет принято решение устранить аритмию и стремиться предотвратить новые приступы или отказаться от попыток устранить аритмию и позволить ей перейти в постоянную форму. При принятии такого решения взвешиваются многие обстоятельства (включая то, насколько тяжело протекает аритмия, какие имеются другие заболевания и факторы риска возникновения этой аритмии, Ваше мнение).
Если принято решение стараться как можно дольше не допускать возобновления фибрилляции предсердий, назначается дополнительное лечение, необходимое для устранения аритмии (прием лекарственных средств, хирургические процедуры). Насколько такие усилия окажутся эффективными и хорошо ли они будут переноситься, можно выяснить только в ходе лечения.
Если окажется, что у Вас велика вероятность инсульта из-за наличия фибрилляции предсердий, необходимо будет постоянно принимать препарат, препятствующий образованию тромбов. При этом крайне важно регулярно принимать такое лекарство, чтобы не допустить ситуации, в которой защита от инсульта ослабеет. Необходимость в приеме препарата, предупреждающего тромбообразование и развитие инсульта, не зависит от того, есть ли у Вас фибрилляция предсердий в настоящее время и как Вы ее переносите.
Кроме того, при фибрилляции предсердий очень важно правильно лечить другие имеющиеся у Вас заболевания и нарушения, способствующие ее возникновению и прогрессированию. Все это требует постоянного контроля врача, что может быть реализовано в рамках диспансерного наблюдения, которое осуществляет врач-терапевт и(или) врач-кардиолог.
Регулярное наблюдение у врача, своевременное обращение за медицинской помощью при ухудшении и соблюдение всех рекомендаций — необходимые условия для уменьшения тяжести течения фибрилляции предсердий, замедления ее прогрессирования и профилактики осложнений.
1 Врач-терапевт — врач-терапевт участковый, врач общей практики (семейный врач), врач-терапевт участковый цехового врачебного участка, фельдшер фельдшерско-акушерского пункта (фельдшерского здравпункта) в случае возложения на него руководителем медицинской организации отдельных функций лечащего врача, в т.ч. по проведению диспансерного наблюдения, в порядке, установленном приказом Министерства здравоохранения и социального развития Российского Федерации от 23 марта 2012 г. № 252н.
2 Приказ Минздрава России от 15.03.2022 №168н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми" (зарегистрирован Министерством юстиции Российской Федерации 21 апреля 2022 г., регистрационный № 68288). СПС Консультант Плюс (10.09.2024).
3 Приказ Минздрава России от 12.05.2021 №435н "Об утверждении стандарта медицинской помощи взрослым при фибрилляции и трепетании предсердий (диагностика, лечение и диспансерное наблюдение)" (зарегистрирован Министерством юстиции Российской Федерации 2 июня 2021 г., регистрационный № 63776). СПС Консультант Плюс (10.09.2024).
4 Приказ Министерства здравоохранения Российской Федерации от 27 апреля 2021 г. № 404н "Об утверждении Порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения" (зарегистрирован Министерством юстиции Российской Федерации 30 июня 2021 г., регистрационный № 64042). СПС Консультант Плюс (07.08.2024).
5 Приказ Минздрава России от 06 декабря 2021 г. № 1122н "Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок" (зарегистрирован Министерством юстиции Российской Федерации 20 декабря 2021 г., регистрационный № 66435). СПС Консультант Плюс (07.08.2024).
6 Приказ Минздрава России от 15 декабря 2014 г. № 834н "Об утверждении унифицированных форм медицинской документации, используемых в медицинских организациях, оказывающих медицинскую помощь в амбулаторных условиях, и порядков по их заполнению" (зарегистрирован Министерством юстиции Российской Федерации 20 февраля 2015г, регистрационный № 36160). СПС Консультант Плюс (07.08.2024).
7 Приказ Минздрава России от 22 ноября 2004 г. № 255 "О Порядке оказания первичной медико-санитарной помощи гражданам, имеющим право на получение набора социальных услуг" (зарегистрирован Министерством юстиции Российской Федерации 14 декабря 2004 г., регистрационный № 6188). СПС Консультант Плюс (07.08.2024).
8 Международная классификация болезней 10-го пересмотра (МКБ-10). https://mkb-10.com/ (05.09.2024).
9 Методика определения баллов по шкалам EHRA, CНА2DS2-VASc и HAS-BLED представлена в таблицах 2, 5, 6, соответственно.
10 Приказ Минздрава России от 27.03.2024 №143н "Об утверждении классификации природных лечебных ресурсов, указанных в пункте 2 статьи 2.1 Федерального закона от 23.02.1995 №26-ФЗ "О природных лечебных ресурсах, лечебно-оздоровительных местностях и курортах", их характеристик и перечня медицинских показаний и противопоказаний для санаторно-курортного лечения и медицинской реабилитации с применением таких природных лечебных ресурсов".
Список литературы
1. Бойцов С.А., Карпов Ю.А. Клиническая фармакология лекарственных средств для лечения заболеваний сердца и сосудов под редакцией. ГЭОТАРМедиа: 2024; 720 с. ISBN: 978-5-4235-0397.
2. Нарушения ритма сердца Глава 33 из "Рациональная фармакотерапия сердечно-сосудистых заболеваний: Руководство" Под общей редакцией Е.И. Чазова, Ю.А. Карпова. 2014. сc. 450-515.
3. Аракелян М. Г., Бокерия Л.А., Васильева Е.Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. doi:10.15829/1560-4071-2021-4594.
4. Peinado R, Arribas F, Ormaetxe JM, Badía X. Variation in quality of life with type of atrial fibrillation. Rev Esp Cardiol. 2010;63(12):1402-9. English, Spanish. doi:10.1016/s1885-5857(10)70274-7.
5. Steinberg BA, Kim S, Fonarow GC, et al. Drivers of hospitalization for patients with atrial fibrillation: Results from the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF). Am Heart J. 2014;167(5):735-42.e2. doi:10.1016/j.ahj.2014.02.003.
6. Benjamin EJ, Muntner P, Alonso A, et al. American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation. 2019;139(10):e56-e528. doi:10.1161/CIR.0000000000000659.
7. Miyasaka Y, Barnes ME, Gersh BJ, et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation. 2006;114(2):119-25. doi:10.1161/CIRCULATIONAHA.105.595140.
8. Heeringa J, van der Kuip DA, Hofman A, et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J. 2006;27(8):949-53. doi:10.1093/eurheartj/ehi825.
9. Naccarelli GV, Varker H, Lin J, Schulman KL. Increasing prevalence of atrial fibrillation and flutter in the United States. Am J Cardiol. 2009;104(11):1534-9. doi:10.1016/j.amjcard.2009.07.022.
10. Stewart S, Hart CL, Hole DJ, McMurray JJ. Population prevalence, incidence, and predictors of atrial fibrillation in the Renfrew/Paisley study. Heart. 2001;86(5):516- 21. doi:10.1136/heart.86.5.516.
11. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA. 2001;285(18):2370-5. doi:10.1001/jama.285.18.2370.
12. Lloyd-Jones DM, Wang TJ, Leip EP, et al. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation. 2004;110(9):1042-6. doi:10.1161/01.CIR.0000140263.20897.42.
13. Roy D, Talajic M, Dorian P, et al. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators. N Engl J Med. 2000;342(13):913-20. doi:10.1056/NEJM200003303421302.
14. Asad ZUA, Yousif A, Khan MS, et al. Catheter Ablation Versus Medical Therapy for Atrial Fibrillation: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Circ Arrhythm Electrophysiol. 2019;12(9):e007414. doi:10.1161/CIRCEP.119.007414.
15. Напалков Д.А., Соколова А.А., Габитова М.А. и др. Прямые оральные антикоагулянты. АБВ-Пресс: Москва; 2019. 96 с.
16. Antithrombotic therapy in cardiology. Ed. Panchenko EP. M.: Remedium Group, 2019. p. 256. (In Russ.) Антитромботическая терапия в кардиологии. Под ред. Панченко Е.П. М.: ООО "Группа Ремедиум", 2019. с. 256. ISBN: 978-5-906499-592.
17. Скирденко Ю.П., Николаев Н.А. Новые подходы к индивидуализированному выбору пероральных антикоагулянтов у больных фибрилляцией предсердий. Рациональная Фармакотерапия в Кардиологии. 2018;14(1):58-64. doi:10.20996/1819-6446-2018-14-1-58-64.
18. Urquhart J, Eisen G, Faigel DO, et al. A closer look at same-day bidirectional endoscopy. Gastrointest Endosc. 2009;69(2):271-7. doi:10.1016/j.gie.2008.04.063.
19. Rockey DC, Koch J, Cello JP, et al. Relative frequency of upper gastrointestinal and colonic lesions in patients with positive fecal occult-blood tests. N Engl J Med. 1998;339(3):153-9. doi:10.1056/NEJM199807163390303.
20. Gage BF, Yan Y, Milligan PE, et al. Clinical classification schemes for predicting hemorrhage: results from the National Registry of Atrial Fibrillation (NRAF). Am Heart J. 2006;151(3):713-9. doi:10.1016/j.ahj.2005.04.017.
21. Hindricks G, Potpara T, Dagres N, et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. doi:10.1093/eurheartj/ehaa612.
22. Andersson T, Magnuson A, Bryngelsson IL, et al. All-cause mortality in 272,186 patients hospitalized with incident atrial fibrillation 1995-2008: a Swedish nationwide long-term case-control study. Eur Heart J. 2013;34(14):1061-7. doi:10.1093/eurheartj/ehs469.
23. Stewart S, Hart CL, Hole DJ, McMurray JJ. A population-based study of the longterm risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/ Paisley study. Am J Med. 2002;113(5):359-64. doi:10.1016/s0002-9343(02)01236-6.
24. Benjamin EJ, Wolf PA, D’Agostino RB, et al. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation. 1998;98(10):946-52. doi:10.1161/01.cir.98.10.946.
25. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke. 1991;22(8):983-8. doi:10.1161/01.str.22.8.983.
26. Krahn AD, Manfreda J, Tate RB, et al. The natural history of atrial fibrillation: incidence, risk factors, and prognosis in the Manitoba Follow-Up Study. Am J Med. 1995;98(5):476-84. doi:10.1016/S0002-9343(99)80348-9.
27. Kotecha D, Holmes J, Krum H, et al. Beta-Blockers in Heart Failure Collaborative Group. Efficacy of β blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet. 2014;384(9961):2235-43. doi:10.1016/S0140-6736(14)61373-8.
28. Grond M, Jauss M, Hamann G, et al. Improved detection of silent atrial fibrillation using 72-hour Holter ECG in patients with ischemic stroke: a prospective multicenter cohort study. Stroke. 2013;44(12):3357-64. doi:10.1161/STROKEAHA.113.001884.
29. Henriksson KM, Farahmand B, Åsberg S, Edvardsson N et al. Comparison of cardiovascular risk factors and survival in patients with ischemic or hemorrhagic stroke. Int J Stroke. 2012;7(4):276-81. doi:10.1111/j.1747-4949.2011.00706.x.
30. Kishore A, Vail A, Majid A, et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack: a systematic review and meta-analysis. Stroke. 2014;45(2):520-6. doi:10.1161/STROKEAHA.113.003433.
31. Kirchhof P, Schmalowsky J, Pittrow D, et al. ATRIUM Study Group. Management of patients with atrial fibrillation by primary-care physicians in Germany: 1-year results of the ATRIUM registry. Clin Cardiol. 2014;37(5):277-84. doi:10.1002/clc.22272.
32. Ulimoen SR, Enger S, Carlson J, et al. Comparison of four single-drug regimens on ventricular rate and arrhythmia-related symptoms in patients with permanent atrial fibrillation. Am J Cardiol. 2013;111(2):225-30. doi:10.1016/j.amjcard.2012.09.020.
33. Scheuermeyer FX, Grafstein E, Stenstrom R, et al. Safety and efficiency of calcium channel blockers versus beta-blockers for rate control in patients with atrial fibrillation and no acute underlying medical illness. Acad Emerg Med. 2013;20(3):222-30. doi:10.1111/acem.12091.
34. Tisdale JE, Padhi ID, Goldberg AD, et al. A randomized, double-blind comparison of intravenous diltiazem and digoxin for atrial fibrillation after coronary artery bypass surgery. Am Heart J. 1998;135:739-47. doi:10.1016/s0002-8703(98)70031-6.
35. Farshi R, Kistner D, Sarma JS, et al. Ventricular rate control in chronic atrial fibrillation during daily activity and programmed exercise: a crossover open-label study of five drug regimens. J Am Coll Cardiol. 1999;33(2):304-10. doi:10.1016/s0735-1097(98)00561-0.
36. Groenveld HF, Tijssen JG, Crijns HJ, et al. RACE II Investigators. Rate control efficacy in permanent atrial fibrillation: successful and failed strict rate control against a background of lenient rate control: data from RACE II (Rate Control Efficacy in Permanent Atrial Fibrillation). J Am Coll Cardiol. 2013;61(7):741-8. doi:10.1016/j.jacc.2012.11.038.
37. David D, Segni ED, Klein HO, Kaplinsky E. Inefficacy of digitalis in the control of heart rate in patients with chronic atrial fibrillation: beneficial effect of an added beta adrenergic blocking agent. Am J Cardiol. 1979;44(7):1378-82. doi:10.1016/0002-9149(79)90456-9.
38. Roth A, Harrison E, Mitani G, et al. Efficacy and safety of medium- and highdose diltiazem alone and in combination with digoxin for control of heart rate at rest and during exercise in patients with chronic atrial fibrillation. Circulation. 1986;73(2):316-24. doi:10.1161/01.cir.73.2.316.
39. Nergårdh AK, Rosenqvist M, Nordlander R, Frick M. Maintenance of sinus rhythm with metoprolol CR initiated before cardioversion and repeated cardioversion of atrial fibrillation: a randomized double-blind placebo-controlled study. Eur Heart J. 2007;28(11):1351-7. doi:10.1093/eurheartj/ehl544.
40. Ziff OJ, Lane DA, Samra M, et al. Safety and efficacy of digoxin: systematic review and meta-analysis of observational and controlled trial data. BMJ. 2015;351:h4451. doi:10.1136/bmj.h4451.
41. Allen LA, Fonarow GC, Simon DN, et al. ORBIT-AF Investigators. Digoxin Use and Subsequent Outcomes Among Patients in a Contemporary Atrial Fibrillation Cohort. J Am Coll Cardiol. 2015;65(25):2691-8. doi:10.1016/j.jacc.2015.04.045.
42. Nikolaidou T, Channer KS. Chronic atrial fibrillation: a systematic review of medical heart rate control management. Postgrad Med J. 2009;85(1004):303-12. doi:10.1136/pgmj.2008.068908.
43. Darby AE, Dimarco JP. Management of atrial fibrillation in patients with structural heart disease. Circulation. 2012;125(7):945-57. doi:10.1161/CIRCULATIONAHA.111.019935.
44. Mulder BA, Van Veldhuisen DJ, Crijns HJ, et al. RACE II Investigators. Digoxin in patients with permanent atrial fibrillation: data from the RACE II study. Heart Rhythm. 2014;11(9):1543-50. doi:10.1016/j.hrthm.2014.06.007.
45. Yu HT, Yang PS, Lee H, et al. Outcomes of Rate-Control Treatment in Patients With Atrial Fibrillation and Heart Failure — A Nationwide Cohort Study. Circ J. 2018;82(3):652-658. doi:10.1253/circj.CJ-17-0669.
46. Clemo HF, Wood MA, Gilligan DM, Ellenbogen KA. Intravenous amiodarone for acute heart rate control in the critically ill patient with atrial tachyarrhythmias. Am J Cardiol. 1998;81(5):594-8. doi:10.1016/s0002-9149(97)00962-4.
47. Delle Karth G, Geppert A, Neunteufl T, et al. Amiodarone versus diltiazem for rate control in critically ill patients with atrial tachyarrhythmias. Crit Care Med. 2001;29(6):1149-53. doi:10.1097/00003246-200106000-00011.
48. Hou ZY, Chang MS, Chen CY, et al. Acute treatment of recent-onset atrial fibrillation and flutter with a tailored dosing regimen of intravenous amiodarone. A randomized, digoxin-controlled study. Eur Heart J. 1995;16(4):521-8. doi:10.1093/oxfordjournals.eurheartj.a060945.
49. Tse HF, Lam YM, Lau CP, et al. Comparison of digoxin versus low-dose amiodarone for ventricular rate control in patients with chronic atrial fibrillation. Clin Exp Pharmacol Physiol. 2001;28(5-6):446-50. doi:10.1046/j.1440-1681.2001.03454.x.
50. Ecker V, Knoery C, Rushworth G, et al. A review of factors associated with maintenance of sinus rhythm after elective electrical cardioversion for atrial fibrillation. Clin Cardiol. 2018;41(6):862-70. doi:10.1002/clc.22931.
51. Airaksinen KE, Grönberg T, Nuotio I, et al. Thromboembolic complications after cardioversion of acute atrial fibrillation: the FinCV (Finnish CardioVersion) study. J Am Coll Cardiol. 2013;62(13):1187-92. doi:10.1016/j.jacc.2013.04.089.
52. Hansen ML, Jepsen RMHG, Olesen JB, et al. Thromboembolic risk in 16274 atrial fibrillation patients undergoing direct current cardioversion with and without oral anticoagulant therapy. EP Eur. 2015;17(1):18-23. doi:10.1093/europace/euu189.
53. Klein AL, Grimm RA, Murray RD, et al. Assessment of Cardioversion Using Transesophageal Echocardiography Investigators. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N Engl J Med. 2001;344(19):1411-20. doi:10.1056/NEJM200105103441901.
54. Hagens VE, Ranchor AV, Van Sonderen E, et al. RACE Study Group. Effect of rate or rhythm control on quality of life in persistent atrial fibrillation. Results from the Rate Control Versus Electrical Cardioversion (RACE) Study. J Am Coll Cardiol. 2004;43(2):241-7. doi:10.1016/j.jacc.2003.08.037.
55. Van Gelder IC, Tuinenburg AE, Schoonderwoerd BS, et al. Pharmacologic versus direct-current electrical cardioversion of atrial flutter and fibrillation. Am J Cardiol. 1999;84(9A):147R-151R. doi:10.1016/s0002-9149(99)00715-8.
56. Фомина И.Г., Тарзиманова А.И., Ветлужский А.В., Абрамова А.А. Пропафенон при восстановлении и сохранении синусового ритма у больных с персистирующей формой фибрилляции предсердий. "ПРОМЕТЕЙ" — открытое мультицентровое исследование в РФ. Рациональная Фармакотерапия в Кардиологии. 2006;2(1):37-40.
57. Тарасов А.В., Косых С.А., Бушуева Е.В. и др. Сравнение эффективности инъекционных форм антиаритмических препаратов пропафенона и амиодарона при проведении фармакологической кардиоверсии пароксизмальной фибрилляции предсердий. Consilium Medicum. 2019;21(1):81-6. doi:10.26442/20751753.2019.1.190286.
58. Pluymaekers NAHA, Dudink EAMP, Luermans JGLM, et al. RACE 7 ACWAS Investigators. Early or Delayed Cardioversion in Recent-Onset Atrial Fibrillation. N Engl J Med. 2019;380(16):1499-508. doi:10.1056/NEJMoa1900353.
59. Camm AJ, Kirchhof P, Lip GY, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J. 2010;31(19):2369-429. doi:10.1093/eurheartj/ehq278.
60. Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur J Cardiothorac Surg. 2016;50(5):e1-e88. doi:10.1093/ejcts/ezw313.
61. Um KJ, McIntyre WF, Healey JS, et al. Pre- and post-treatment with amiodarone for elective electrical cardioversion of atrial fibrillation: a systematic review and metaanalysis. Europace. 2019;21(6):856-63. doi:10.1093/europace/euy310.
62. Singh SN, Tang XC, Reda D, Singh BN. Systematic electrocardioversion for atrial fibrillation and role of antiarrhythmic drugs: a substudy of the SAFE-T trial. Heart Rhythm. 2009;6(2):152-5. doi:10.1016/j.hrthm.2008.10.036.
63. Lip GY, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest. 2010;137(2):263-72. doi:10.1378/chest.09-1584.
64. Hart RG, Pearce LA, Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med. 2007;146(12):857-67. doi:10.7326/0003-4819-146-12-200706190-00007.
65. Joundi RA, Cipriano LE, Sposato LA, Saposnik G; Stroke Outcomes Research Working Group. Ischemic Stroke Risk in Patients With Atrial Fibrillation and CHA2DS2-VASc Score of 1: Systematic Review and Meta-Analysis. Stroke. 2016;47(5):1364-7. doi:10.1161/STROKEAHA.115.012609.
66. Lip GY, Lane DA. Stroke prevention in atrial fibrillation: a systematic review. JAMA. 2015;313(19):1950-62. doi:10.1001/jama.2015.4369.
67. Potpara TS, Polovina MM, Licina MM, et al. Reliable identification of "truly low" thromboembolic risk in patients initially diagnosed with "lone" atrial fibrillation: the Belgrade atrial fibrillation study. Circ Arrhythm Electrophysiol. 2012;5(2):319- 26. doi:10.1161/CIRCEP.111.966713.
68. Chao TF, Liao JN, Tuan TC, et al. Incident Co-Morbidities in Patients with Atrial Fibrillation Initially with a CHA2DS2-VASc Score of 0 (Males) or 1 (Females): Implications for Reassessment of Stroke Risk in Initially ‘Low-Risk’ Patients. Thromb Haemost. 2019;119(7):1162-70. doi:10.1055/s-0039-1683933.
69. Chao TF, Lip GYH, Lin YJ, Chang SL, et al. Incident Risk Factors and Major Bleeding in Patients with Atrial Fibrillation Treated with Oral Anticoagulants: A Comparison of Baseline, Follow-up and Delta HAS-BLED Scores with an Approach Focused on Modifiable Bleeding Risk Factors. Thromb Haemost. 2018;118(4):768-77. doi:10.1055/s-0038-1636534.
70. Rubboli A, Becattini C, Verheugt FW. Incidence, clinical impact and risk of bleeding during oral anticoagulation therapy. World J Cardiol. 2011;3(11):351-8. doi:10.4330/wjc.v3.i11.351.
71. Pisters R, Lane DA, Nieuwlaat R, et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest. 2010;138(5):1093-100. doi:10.1378/chest.10-0134.
72. Chang G, Xie Q, Ma L, Hu K, et al. Accuracy of HAS-BLED and other bleeding risk assessment tools in predicting major bleeding events in atrial fibrillation: A network meta-analysis. J Thromb Haemost. 2020;18(4):791-801. doi:10.1111/jth.14692.
73. Lip GY, Lane DA. Bleeding risk assessment in atrial fibrillation: observations on the use and misuse of bleeding risk scores. J Thromb Haemost. 2016;14(9):1711-4. doi:10.1111/jth.13386.
74. Böhm M, Ezekowitz MD, Connolly SJ, et al. Changes in Renal Function in Patients With Atrial Fibrillation: An Analysis From the RE-LY Trial. J Am Coll Cardiol. 2015;65(23):2481-93. doi:10.1016/j.jacc.2015.03.577.
75. Hijazi Z, Hohnloser SH, Andersson U, et al. Efficacy and Safety of Apixaban Compared With Warfarin in Patients With Atrial Fibrillation in Relation to Renal Function Over Time: Insights From the ARISTOTLE Randomized Clinical Trial. JAMA Cardiol. 2016;1(4):451-60. doi:10.1001/jamacardio.2016.1170.
76. Steffel J, Verhamme P, Potpara TS, et al. ESC Scientific Document Group. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J. 2018;39(16):1330-93. doi:10.1093/eurheartj/ehy136.
77. Mueck W, Kubitza D, Becka M. Co-administration of rivaroxaban with drugs that share its elimination pathways: pharmacokinetic effects in healthy subjects. Br J Clin Pharmacol. 2013;76(3):455-66. doi:10.1111/bcp.12075.
78. Wang L, Zhang D, Raghavan N, et al. In vitro assessment of metabolic drugdrug interaction potential of apixaban through cytochrome P450 phenotyping, inhibition, and induction studies. Drug Metab Dispos. 2010;38(3):448-58. doi:10.1124/dmd.109.029694.
79. Liesenfeld KH, Lehr T, Dansirikul C, et al. Population pharmacokinetic analysis of the oral thrombin inhibitor dabigatran etexilate in patients with non-valvular atrial fibrillation from the RE-LY trial. J Thromb Haemost. 2011;9(11):2168-75. doi:10.1111/j.1538-7836.2011.04498.x.
80. Halperin JL, Hankey GJ, Wojdyla DM, et al. ROCKET AF Steering Committee and Investigators. Efficacy and safety of rivaroxaban compared with warfarin among elderly patients with nonvalvular atrial fibrillation in the Rivaroxaban Once Daily, Oral, Direct Factor Xa Inhibition Compared With Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF). Circulation. 2014;130(2):138-46. doi:10.1161/CIRCULATIONAHA.113.005008.
81. Halvorsen S, Atar D, Yang H, et al. Efficacy and safety of apixaban compared with warfarin according to age for stroke prevention in atrial fibrillation: observations from the ARISTOTLE trial. Eur Heart J. 2014;35(28):1864-72. doi:10.1093/eurheartj/ehu046.
82. Eikelboom JW, Wallentin L, Connolly SJ, et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulant therapy (RE-LY) trial. Circulation. 2011;123(21):2363-72. doi:10.1161/CIRCULATIONAHA.110.004747.
83. Granger CB, Alexander JH, McMurray JJ, et al. ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981-92. doi:10.1056/NEJMoa1107039.
84. Braekkan SK, van der Graaf Y, Visseren FL, Algra A. Obesity and risk of bleeding: the SMART study. J Thromb Haemost. 2016;14(1):65-72. doi:10.1111/jth.13184.
85. Siontis KC, Zhang X, Eckard A, et al. Outcomes Associated With Apixaban Use in Patients With End-Stage Kidney Disease and Atrial Fibrillation in the United States. Circulation. 2018;138(15):1519-29. doi:10.1161/CIRCULATIONAHA.118.035418.
86. Stanton BE, Barasch NS, Tellor KB. Comparison of the Safety and Effectiveness of Apixaban versus Warfarin in Patients with Severe Renal Impairment. Pharmacotherapy. 2017;37(4):412-9. doi:10.1002/phar.1905.
87. Weir MR, Ashton V, Moore KT, et al. Rivaroxaban versus warfarin in patients with nonvalvular atrial fibrillation and stage IV-V chronic kidney disease. Am Heart J. 2020;223:3-11. doi:10.1016/j.ahj.2020.01.010.
88. Kubitza D, Roth A, Becka M, et al. Effect of hepatic impairment on the pharmacokinetics and pharmacodynamics of a single dose of rivaroxaban, an oral, direct Factor Xa inhibitor. Br J Clin Pharmacol. 2013;76(1):89-98. doi:10.1111/bcp.12054.
89. Intagliata NM, Henry ZH, Maitland H, et al. Direct Oral Anticoagulants in Cirrhosis Patients Pose Similar Risks of Bleeding When Compared to Traditional Anticoagulation. Dig Dis Sci. 2016;61(6):1721-7. doi:10.1007/s10620-015-4012-2.
90. Hum J, Shatzel JJ, Jou JH, Deloughery TG. The efficacy and safety of direct oral anticoagulants vs traditional anticoagulants in cirrhosis. Eur J Haematol. 2017;98(4):393-7. doi:10.1111/ejh.12844.
91. De Caterina R, Husted S, Wallentin L, et al. Vitamin K antagonists in heart disease: current status and perspectives (Section III). Position paper of the ESC Working Group on Thrombosis — Task Force on Anticoagulants in Heart Disease. Thromb Haemost. 2013;110(6):1087-107. doi:10.1160/TH13-06-0443.
92. Wan Y, Heneghan C, Perera R, et al. Anticoagulation control and prediction of adverse events in patients with atrial fibrillation: a systematic review. Circ Cardiovasc Qual Outcomes. 2008;1(2):84-91. doi:10.1161/CIRCOUTCOMES.108.796185.
93. Hylek EM, Skates SJ, Sheehan MA, Singer DE. An analysis of the lowest effective intensity of prophylactic anticoagulation for patients with nonrheumatic atrial fibrillation. N Engl J Med. 1996;335(8):540-6. doi:10.1056/NEJM199608223350802.
94. Pathak RK, Middeldorp ME, Lau DH, et al. Aggressive risk factor reduction study for atrialfibrillation and implicationsfor the outcome of ablation: the ARREST-AF cohort study. J Am CollCardiol. 2014;64(21):2222-31. doi:10.1016/j.jacc.2014.09.028.
95. Abed HS, Wittert GA, Leong DP, et al. Effect of weight reduction and cardiometabolic risk factormanagementon symptom burden and severity in patients with atrial fibrillation: a randomizedclinical trial. JAMA. 2013;310(19):2050-60. doi:10.1001/jama.2013.280521.
96. Manolis AJ, Rosei EA, Coca A, et al. Hypertensionand atrial fibrillation: diagnostic approach, prevention and treatment. Position paperof the Working Group "Hypertension Arrhythmias and Thrombosis" of the European Society of Hypertension. J Hypertens. 2012;30(2):239-52. doi:10.1097/HJH.0b013e32834f03bf.
97. Kotecha D, Chudasama R, Lane DA, et al. Atrial fibrillation and heart failure due to reduced versuspreserved ejection fraction: A systematic reviewand meta-analysis of death and adverse outcomes. Int J Cardiol. 2016;203:660-6. doi:10.1016/j.ijcard.2015.10.220.
98. Stewart S, Ball J, Horowitz JD, et al. Standard versus atrial fibrillation-specific managementstrategy (SAFETY) to reduce recurrent admission and prolong survival: pragmatic, multicentre, randomised controlled trial. Lancet. 2015;385(9970):775- 84. doi:10.1016/S0140-6736(14)61992-9.
99. An J, Niu F, Zheng C, et al. Warfarin Management and Outcomes in Patients with NonvalvularAtrial Fibrillation Within an Integrated Health Care System. J Manag Care Spec Pharm. 2017;23(6):700-12. doi:10.18553/jmcp.2017.23.6.700.
100. Connolly SJ, Ezekowitz MD, Yusuf S, et al.; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-51. doi:10.1056/NEJMoa0905561.
101. Faust O, Ciaccio EJ, Acharya UR. A Review of Atrial Fibrillation Detection Methods as a Service. Int J Environ Res Public Health. 2020;17(9):3093. doi:10.3390/ijerph17093093.
102. Wynn GJ, Todd DM, Webber M, et al. The European Heart Rhythm Association symptom classification for atrial fibrillation: validation and improvement through a simple modification. Europace. 2014;16(7):965-72. doi:10.1093/europace/eut395.
103. Giugliano RP, Ruff CT, Braunwald E et al. Edoxaban versus warfarin in patients with atrialfibrillation. N Engl J Med. 2013;369(22):2093-104. doi:10.1056/NEJMoa1310907.
104. Clarkesmith DE, Pattison HM, Lip GY, Lane DA. Educational intervention improvesanticoagulation control in atrial fibrillation patients: the TREAT randomised trial. PLoS One. 2013;8(9):e74037. doi:10.1371/journal.pone.0074037.
105. Aliot E, Breithardt G, Brugada J, et al. Atrial Fibrillation AWareness and Risk Education group [comprising the Atrial Fibrillation Association (AFA), the European Heart Rhythm Association (EHRA), Stroke Alliance for Europe (SAFE), and the World Heart Federation (WHF)]. Aninternational survey of physician and patient understanding, perception, and attitudes to atrialfibrillation and its contribution to cardiovascular disease morbidity and mortality. Europace. 2010;12:626-33.
106. Hohnloser SH, Crijns H, Jvan Eickels M, et al. Effect of dronedarone on cardiovascular events inatrial fibrillation. N Engl J Med. 2009;360(7):668-78. doi:10.1056/NEJMoa0803778.
107. Лукина Ю.В., Кутишенко Н.П., Марцевич С.Ю., Драпкина О.М. Разработка и валидизация новых опросников в медицине на примере шкалы приверженности лекарственной терапии. Рациональная Фармакотерапия в Кардиологии. 2021;17(4):576-83. doi:10.20996/1819-6446-2021-08-02.
Об авторах
О. М. ДрапкинаРоссия
Д.м.н., профессор, академик РАН, директор ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России, зав. кафедрой терапии и профилактической медицины ФГБОУ ВО "Российский университет медицины" Минздрава России
Москва
С. А. Бойцов
Д.м.н., профессор, академик РАН, генеральный директор ФГБУ "НМИЦ кардиологии им. акад. Е. И. Чазова" Минздрава России, профессор кафедры поликлинической терапии поликлинической терапии ФГБОУ ВО "Российский университет медицины" Минздрава России
Москва
Е. З. Голухова
Д.м.н., профессор, академик РАН, директор ФГБУ "Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А. Н. Бакулева" Минздрава России
Москва
К. В. Давтян
Д.м.н., профессор, руководитель отдела нарушений сердечного ритма и проводимости ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
Л. Ю. Дроздова
К.м.н., руководитель лаборатории поликлинической терапии ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
П. В. Ипатов
Д.м.н., профессор, главный научный сотрудник ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
А. М. Калинина
Д.м.н., профессор, руководитель отдела первичной профилактики хронических неинфекционных заболеваний в системе здравоохранения ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
С. Ю. Марцевич
Д.м.н., профессор, руководитель отдела профилактической фармакотерапии, главный научный сотрудник ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
Е. Д. Савченко
К.м.н., ведущий научный сотрудник отдела научно-стратегического развития первичной медико-санитарной помощи, доцент кафедры общественного здоровья и здравоохранения Института профессионального образования и аккредитации ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
М. С. Харлап
К.м.н., ведущий научный сотрудник отдела нарушений сердечного ритма и проводимости ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
Р. Н. Шепель
К.м.н., зам. директора по перспективному развитию медицинской деятельности, руководитель отдела научно-стратегического развития первичной медико-санитарной помощи, ведущий научный сотрудник отдела научно-стратегического развития первичной медикосанитарной помощи, доцент кафедры общественного здоровья и организации здравоохранения ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России, доцент кафедры терапии и профилактической медицины ФГБОУ ВО "Российский университет медицины" Минздрава России
Москва
И. С. Явелов
Д.м.н., профессор, руководитель отдела фундаментальных и клинических проблем тромбоза при неинфекционных заболеваниях ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Москва
Л. М. Жамалов
Врач-методист группы по организации медицинской помощи отдела организационно-методического управления и анализа оказания медицинской помощи ФГБУ "Национальный медицинский центр терапии и профилактической медицины" Минздрава России
Москва
Рецензия
Для цитирования:
Драпкина ОМ, Бойцов СА, Голухова ЕЗ, Давтян КВ, Дроздова ЛЮ, Ипатов ПВ, Калинина АМ, Марцевич СЮ, Савченко ЕД, Харлап МС, Шепель РН, Явелов ИС, Жамалов ЛМ. Диспансерное наблюдение пациентов с фибрилляцией и трепетанием предсердий врачом-терапевтом в первичном звене здравоохранения. Методические рекомендации. Первичная медико-санитарная помощь. 2024;1(1):134-178. https://doi.org/10.15829/3034-4123-2024-24. EDN: IXJDOK
For citation:
Drapkina OM, Boytsov SA, Golukhova EZ, Davtyan KV, Drozdova LY, Ipatov PV, Kalinina AM, Martsevich SY, Savchenko ED, Kharlap MS, Shepel RN, Yavelov IS, Zhamalov LM. Outpatient follow-up of patients with atrial fibrillation and flutter by a primary care physician. Guidelines. Primary Health Care (Russian Federation). 2024;1(1):134-178. (In Russ.) https://doi.org/10.15829/3034-4123-2024-24. EDN: IXJDOK





















