Перейти к:
Скрининг злокачественных новообразований молочной железы в рамках диспансеризации определенных групп взрослого населения. Методические рекомендации
https://doi.org/10.15829/3034-4123-2024-5
EDN: VXVFHX
Аннотация
Методические рекомендации содержат информацию о теоретических основах скрининга злокачественных новообразований молочной железы, нормативно-правовых актах, регламентирующих организацию мероприятий скрининга в рамках диспансеризации определенных групп взрослого населения, алгоритмах диагностики и маршрутизации обследуемых лиц.
Методические рекомендации разработаны для руководителей медицинских организаций, оказывающих первичную медико-санитарную помощь в части организации процессов, врачей-терапевтов, врачей общей практики, медицинских работников из числа среднего медицинского персонала, которые непосредственно участвуют в реализации процесса диспансеризации определенных групп взрослого населения.
Ключевые слова
Для цитирования:
Драпкина ОМ, Каприн АД, Алмазова ИИ, Дроздова ЛЮ, Иванова ЕС, Рожкова НИ, Рубцова НА, Хайлова ЖВ, Шепель РН. Скрининг злокачественных новообразований молочной железы в рамках диспансеризации определенных групп взрослого населения. Методические рекомендации. Первичная медико-санитарная помощь. 2024;1(1):63-80. https://doi.org/10.15829/3034-4123-2024-5. EDN: VXVFHX
For citation:
Drapkina OM, Kaprin AD, Almazova II, Drozdova LY, Ivanova ES, Rozhkova NI, Rubtsova NA, Khailova JV, Shepel RN. Screening of malignant neoplasms of the breast as part of the medical examination of certain groups of the adult population. Guidelines. Primary Health Care (Russian Federation). 2024;1(1):63-80. (In Russ.) https://doi.org/10.15829/3034-4123-2024-5. EDN: VXVFHX
Введение
Вопросы своевременного выявления злокачественных новообразований (ЗНО) молочной железы остаются важнейшей проблемой современного здравоохранения во всем мире. Несмотря на совершенствование диагностического оборудования и методов лечения ЗНО, рак молочной железы (РМЖ) занимает лидирующие позиции в заболеваемости и смертности у женщин.
По данным агентства GLOBOCAN, в 2022 г. в мире зарегистрировано 2 296 840 случаев РМЖ, что составляет 11,5% от всех ЗНО1. По данным Всемирной организации здравоохранения (ВОЗ), примерно в половине случаев РМЖ встречается у женщин, не имеющих каких-либо специфических факторов риска, за исключением пола и возраста. Смертность при РМЖ в 2022 г. составила 666 103 (6,8% всей смертности от ЗНО)2. РМЖ остается основной причиной смерти от ЗНО у женщин1 2.
В Российской Федерации (РФ) РМЖ занимает ведущие позиции в структуре как общей онкологической заболеваемости (12,3%), так и в структуре заболеваемости ЗНО у женщин (22,4%). В 2022 г. в РФ выявлено 76 520 новых случаев РМЖ [1]. Причем наибольший удельный вес заболеваемости РМЖ приходится на возрастную группу 30-59 лет (17,8%). Количество выявляемых случаев РМЖ растет, среднегодовой темп прироста составляет 1,51%, прирост с 2012 по 2022 гг. составил 19,26%. РМЖ, наряду с раком шейки матки, является наиболее часто встречающейся онкологической патологией у женщин репродуктивного возраста в нашей стране.
В структуре смертности от ЗНО в РФ РМЖ сохраняет печальное лидерство у женщин старше 40 лет (в возрасте 40-49 лет — 23,1%, 50-59 лет — 20,5%, 60-69 лет — 16,3%, старше 70 лет — 13,3%). У женщин 30-39 лет смертность от РМЖ составляет 22%, уступая лишь раку шейки матки (23%) [1].
В течение последних 20 лет отмечается устойчивая тенденция к "омоложению" РМЖ. Все чаще РМЖ диагностируется в возрасте до 40 лет (7%). В мировой научной литературе выделяется также группа больных очень молодого возраста (младше 35 лет), заболеваемость в которой составляет 2,6-7,5%. Причем показатели выживаемости у больных младше 40 лет ниже, чем у пациенток старших возрастных групп [2].
Таким образом, медицинская и социальная значимость проблемы, требует повышения внимания к проведению скрининговых мероприятий и разработке алгоритмов ранней диагностики РМЖ.
Основным инструментом системы здравоохранения, позволяющим снизить смертность от ЗНО молочной железы (ЗНОМЖ) является эффективный скрининг.
Глава I. ОСНОВЫ ОРГАНИЗАЦИИ СКРИНИНГА РАКА
МОЛОЧНОЙ ЖЕЛЕЗЫ
Раздел 1. Скрининг: определение, правила организации
Термин "скрининг" (англ. screening — отбор, сортировка, просеивание) часто используется в мировой медицинской литературе и научных публикациях, но до сих пор нет единого определения понятия "скрининг" [3].
Впервые определение и принципы скрининга были сформулированы экспертами ВОЗ James Maxvell Glover Wilson и Gunnar Jungner в 1968 г.3:
"Скрининг — предположительная идентификация не выявленной болезни или дефекта путем использования тестов, анализов или других процедур, которые можно применить быстро. Скрининг-тесты позволяют выделить внешне здоровых лиц, которые предположительно страдают от тех или иных болезней, среди тех, которые предположительно этих болезней не имеют. Скрининг-тесты не претендуют на диагностическое значение. Лица с положительными или подозрительными результатами должны направляться к врачам для установления диагноза и необходимого лечения"3 4.
Под скринингом понимается активное выявление болезни у лиц, в том числе считающих себя здоровыми, или считающихся здоровыми и не имеющих симптомов выявляемого заболевания (рисунок 1)4.
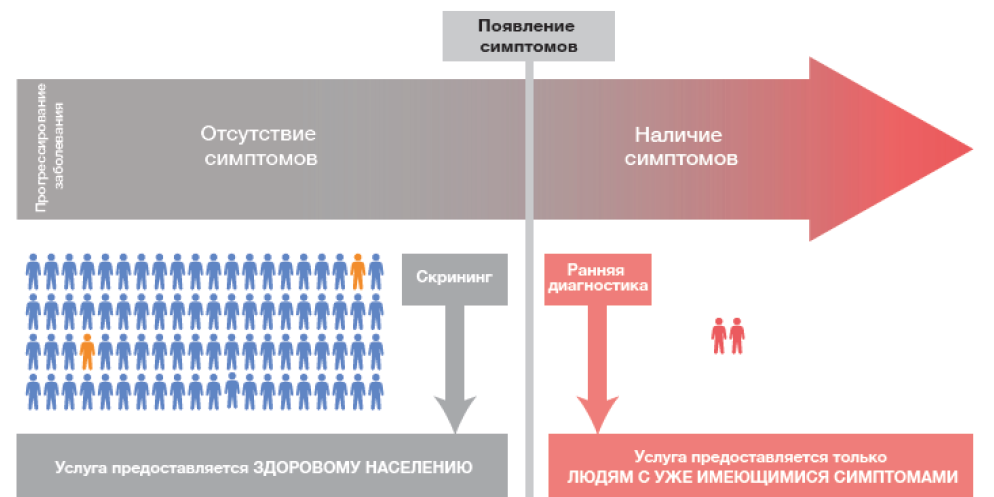
Рис. 1. Отличие скрининга от ранней диагностики рака с учетом появления симптомов (Программы скрининга: краткое руководство. Повышение эффективности, максимальное увеличение пользы и минимизация вреда. Копенгаген: Европейское региональное бюро ВОЗ; 2020)4.
Целесообразность проведения скрининга того или иного заболевания определяется, согласно Wilson JMG и Jungner G, 10 принципами3,4:
- Выявляемое заболевание должно представлять собой значимую проблему для здоровья человека.
- Должны быть доступны методы диагностики заболевания.
- Должны существовать эффективные и доступные методы лечения заболевания.
- Выявляемое заболевание должно иметь распознаваемую раннюю клиническую и/или латентную стадию.
- Должны существовать подходящие для скрининга диагностические тесты или исследования.
- Методы диагностики, применяемые в качестве скрининговых тестов, должны быть приемлемыми для населения.
- Закономерности развития заболевания от латентной формы до стадии клинических проявлений должны быть хорошо исследованы и понятны.
- Должен быть четко обозначен принцип определения лиц, нуждающихся в лечении.
- Затраты на выявление случаев болезни (включая скрининг, диагностику и лечение) должны быть экономически сбалансированы с возможными затратами на медицинское обслуживание в целом.
- Проведение скрининга должно быть непрерывным, последовательным процессом, а не единовременной акцией.
Цели скрининга заболеваний включают4:
— снижение уровня смертности путем раннего выявления и лечения заболевания;
— снижение частоты возникновения заболевания посредством выявления и лечения состояний, предшествующих его развитию;
— снижение степени тяжести заболевания посредством раннего выявления и эффективного лечения;
— расширение возможностей выбора тактики лечения за счет выявления заболеваний или факторов риска на более ранних этапах жизни, когда доступно больше вариантов лечения и методов воздействия на факторы риска.
Для каждой программы скрининга, в зависимости от выявляемого заболевания, должны быть сформулированы цели, которые определяют содержание и структуру программы4.
Скрининг РМЖ направлен на снижение смертности от заболевания за счет раннего выявления ЗНОМЖ у клинически бессимптомных лиц и своевременного лечения4. Целью скрининга РМЖ является распознавание ЗНО на ранних стадиях, что снижает частоту метастазирования, смертность, увеличивает выживаемость и дает возможность проведения органосберегающего лечения, повышающего качество жизни женщины.
Процесс скрининга представляет собой диагностический маршрут, результативность которого определяется в первую очередь чувствительностью и специфичностью выбранного скрининг-теста.
По охвату населения скрининг разделяется на [3]:
— популяционный, являющийся широкомасштабным процессом, в ходе которого скрининговому обследованию подлежат значительные группы населения;
— выборочный, осуществляемый в определенных группах населения;
— целевой, проводимый в группах высокого риска развития определенного заболевания.
Диспансеризация определенных групп взрослого населения (ДОГВН) является популяционным скринингом.
Ключевые критерии успешной реализации программы скрининга РМЖ5:
- Доступность и экономическая эффективность программ скрининга.
- Оптимальная координация всех мероприятий скрининга: нормативное регулирование, планирование, техническое и материальное обеспечение, контроль качества проводимых мероприятий.
- Планирование борьбы против рака и интеграция процессов скрининга ЗНО в национальную стратегию профилактики неинфекционных заболеваний.
- Сбалансированное, объективное информирование женщин о пользе и вреде скринингового теста — рентгеновской маммографии (РМГ).
- Утвержденные алгоритмы и протоколы для всех этапов скрининга, включая идентификацию и приглашение женщин, имеющих право на участие в скрининге, проведение скринингового теста, диагностику, лечение и паллиативную помощь.
- Соблюдение руководящих принципов обеспечения качества скрининга, основанных на данных доказательной медицины.
- Организация контроля качества проводимого скрининга. Мониторинг и оценка эффективности по анализу результатов скрининга6.
Основными условиями качественного РМГ-скри-
нинга являются:
— создание материально-технической и кадровой базы для проведения РМГ-скрининга;
— широкомасштабная информационно-просветительская работа с целью активного привлечения женщин на РМГ.
Снижение смертности благодаря скринингу РМЖ составляет 15-25% по данным рандомизированных исследований и 28-56% по данным обсервационных [4].
К факторам риска РМЖ относятся6:
— генетические мутации BRCA 1, BRCA 2, ТР53, р53, PTEN, СНЕК-2, CDH-I;
— наличие у 2-х и более родственников первой линии родства (мать, сестра, дочь, отец, брат, сын) ЗНО яичников, молочной железы, поджелудочной железы;
— медицинское или техногенное облучение грудной клетки в возрасте до 30 лет в анамнезе.
В настоящее время в разных странах существуют также калькуляторы, шкалы, опросники, позволяющие рассчитать индивидуальный риск развития РМЖ и, таким образом, выделить группу женщин с высоким риском заболевания (BRCAPRO, BOADICEA (Breast and Ovarian Analysis of Disease Incidence and Carrier Estimation Algorithm), BCSC (Breast Cancer Surveillance Consortium) Risk Calculator, Gail model, Cuzick-Tyrer model) [5].
Скрининг РМЖ в России проводится в рамках ДОГВН7.
Раздел 2. Скрининговый тест
При проведении скрининга любого заболевания определяющим является выбор скринингового теста, его чувствительность и специфичность.
После открытия в 1895 г. Вильгельмом Конрадом Рентгеном Х-лучей для визуализации внутренних органов, названных в честь автора "рентгеновскими", медиками всего мира предпринимались попытки применения их для диагностики различных заболеваний, но лишь в 1913 г. немецкий врач Альберт Соломон впервые опубликовал данные о рентгенографии удаленной по поводу РМЖ молочной железы [6]. Дальнейшие исследования возможностей рентгеновской диагностики привели к тому, что в 60-х годах прошлого столетия РМГ была выделена как отдельная методика в радиологии, а в последующем получила широкое применение как метод диагностики РМЖ [6]. С совершенствованием РМГ появилась возможность диагностировать ранние, доклинические стадии РМЖ. В последующие годы было проведено множество исследований по изучению эффективности и безопасности этого метода обследования не только при диагностике РМЖ, но и при проведении скрининга. Широкое внедрение РМГ в качестве скринингового теста для РМЖ основано на анализе результатов указанных клинических исследований, которые продемонстрировали снижение риска смерти от РМЖ на 20%5 [7]. В настоящее время РМГ является основным скрининговым тестом для выявления РМЖ, используемым во всем мире и доказавшим свою эффективность.
Оценка потенциального вреда от проведения РМГ в качестве скринингового теста касается анализа таких явлений, сопровождающих РМГ-скрининг, как:
— ионизирующее излучение;
— снижение качества жизни за счет повышения уровня тревожности;
— гипердиагностика;
— ложнонегативные результаты;
— интервальный рак.
Ионизирующее излучение
Повторяющаяся с 40 лет каждые 2 года РМГ несет определенную суммарную лучевую нагрузку, которая, согласно современным данным, незначительна [8]. Риск развития РМЖ, индуцированного рентгеновским облучением при проведении регулярного РМГ-скрининга каждые 2 года с 40 до 75 лет крайне мал [9]. Согласно Классификации рентгенологических исследований по радиационному риску у пациентов разных возрастных групп, РМГ относится к методикам низкого риска для возрастной группы 18-64 года, и очень низкого риска для возрастной группы 65 и более лет [10]. В среднем эффективная облучения при РМГ составляет 0,03-0,05 мЗв на проекцию, таким образом на скрининговое исследование молочных желез приходится доза 0,1-0,2 мЗв. Для сравнения — фоновый уровень естественной радиации, который воздействует на каждого человека составляет 2,4 мЗв в год. Рентгеновские сканнеры, применяемые в аэропортах и некоторых общественных местах, производят облучение до 5 мкЗв. При авиаперелете человек получает до 5 мкЗв в час. По данным United Nations Scientific Committee on the Effects of Atomic Radiation (UNSCEAR), самый низкий годовой уровень облучения, при достижении которого очевидно увеличение риска развития рака равен 100 мЗв. При превышении этого уровня предполагается, что вероятность возникновения рака увеличивается. При годовом фоне облучения ниже указанной дозы не было доказано никаких отрицательных эффектов8.
Снижение качества жизни за счет повышения уровня тревожности
Одной из причин повышения уровня тревожности у женщин при проведении РМГ-скрининга является боязнь болевых ощущений во время исследования. Однако при правильной укладке молочной железы женщина испытывает лишь умеренное ощущение компрессии молочной железы, но не боль.
Ложноположительные результаты, приводящие к ненужному дополнительному обследованию, так же повышают уровень тревожности и могут приводить к стремлению избежать скрининговых исследований в последующем. Крайне важной является четкая организация процессов дообследования при их необходимости. Все требуемые диагностические мероприятия должны быть выполнены предпочтительно мультимодальным специалистом — лучевым диагностом, владеющим всеми методами лучевой неинвазивной и инвазивной диагностики, в короткие сроки (в соответствии с действующими стандартами — не более 5 рабочих дней) [5][11].
Гипердиагностика
Неспецифичность рентгенологических проявлений непальпируемого рака, в том числе и рака in situ, может приводить к гипердиагностике при РМГ-скрининге [5]. В сомнительных случаях может быть назначено дообследование вне рамок диспансеризации: контрастная двуэнергетическая РМГ — CEM (contrast-enchanced mammogram), а при высокой маммографической плотности (МП) — ультразвуковое исследование (УЗИ) и/или магнитно-резонансная томография (МРТ) с динамическим контрастным усилением, которые дополняют информацию и в большинстве случаев снимают диагностические вопросы. В ряде крупных исследований было показано, что на каждые один или два случая гипердиагностики удалось избежать по крайней мере одной смерти от РМЖ, исходя из этого баланс между пользой и вредом был признан целесообразным5 [12-15].
Ложнонегативные результаты, интервальный рак
Ложнонегативные результаты могут быть обусловлены наличием состояний, негативно влияющих на информативность РМГ:
— высокая рентгенологическая плотность ткани молочных желез (тип плотности C, D): при таких вариантах МП информативность исследования существенно снижается, поэтому пациентка должна направляться на дополнительное обследование вне рамок диспансеризации (УЗИ, МРТ с динамическим контрастным усилением или контрастную двуэнергетическую РМГ6 [5][16];
— особенности роста новообразований: злокачественные опухоли, схожие по плотности с окружающими тканями молочной железы, без типичных кальцинатов; экспансивно растущие ЗНО с признаками доброкачественного процесса; ЗНО, проявляющиеся в виде нарушения архитектоники ткани молочной железы.
Интервальный рак — рак молочной железы, возникающий во временном периоде между эпизодом негативного скрининга и следующим запланированным проведением скрининга. В этой группе ЗНО могут быть как опухоли, сформировавшиеся в межскрининговый период, так и не выявленные при предыдущем скрининге. Необходимо стремиться к минимизации интервальных раков, поскольку их большое количество говорит о низкой эффективности программы скрининга [5].
Корректное выполнение РМГ с двойным прочтением рентгенограмм, дальнейшая персонализация скрининга с дообследованием при необходимости, являются ключевыми факторами в снижении числа ложнонегативных результатов при скрининге.
В РФ для скрининга РМЖ в рамках первого этапа ДОГВН [17] в настоящее время используется РМГ в прямой и косой проекциях (craniocaudal — CC, и mediolateral oblique — MLO). Исследование проводится женщинам 40-75 лет с периодичностью в 2 года. У женщин с наличием менструального цикла исследование осуществляется на 5-12 день цикла. Обязательным является прочтение маммограмм двумя независимыми врачами-рентгенологами, каждый из которых формирует отдельное заключение6 [5]. Одно из прочтений маммограмм может осуществляться с применением телемедицинских технологий. При расхождении мнений рентгенологов дальнейший диагностический маршрут формируется исходя из заключения с более высокой категорией BI-RADS.
Описание рентгенограмм должно включать использование системы оценки рентгенологической плотности молочных желез по ACR (American College of Radiology) и системы BI-RADS (Breast Imaging Reporting and Data System).
При оценке маммографического изображения типы плотности молочных желез согласно классификации ACR разделяются следующим образом:
ACR A — соответствует картине фиброзно-жировой инволюции, где железистая ткань занимает 0-25% объема молочной железы;
ACR B — рассеянные плотные структуры, состоящие из фиброзно-железистой ткани, занимают 25-50% объема железы;
ACR C — неоднородная структура железы с асимметричными участками плотных структур (51-75% фиброзно-железистой ткани);
ACR D — плотные структуры, состоящие из фиброзно-железистой ткани, составляют более 75% объема молочной железы.
Повышенная рентгенологическая плотность молочных желез снижает информативность маммографического исследования и ассоциирована с повышенным риском развития РМЖ. Выявление высокой рентгенологической плотности молочных желез (тип C и D) является основанием для персонификации программы скрининга — прохождению дополнительного обследования (УЗИ и/или МРТ молочных желез) вне рамок диспансеризации.
Использование системы BI-RADS позволяет унифицировать заключения для верной классификации структурных изменений ткани молочной железы и определения плана дальнейшего обследования, обеспечивать преемственность всего лечебно-диагностического процесса при выявлении патологии. В системе BI-RADS выделено 7 категорий оценки маммографических данных6 [18-20]:
BI-RADS 0 — неполные/недостаточные данные, требуется дополнительная визуализация и/или предыдущие маммограммы для сравнения;
BI-RADS 1 — норма, патологических изменений нет;
BI-RADS 2 — доброкачественные изменения молочной железы;
BI-RADS 3 — вероятно, доброкачественные изменения (вероятность наличия РМЖ не выше 2%);
BI-RADS 4 — подозрение на ЗНО (вероятность РМЖ от 2 до 95%);
4А — низкая вероятность злокачественности (2-10%);
4В — средняя вероятность злокачественности (10-50%);
4С — высокая вероятность злокачественности (51-95%);
BI-RADS 5 — высокая степень подозрения на РМЖ (вероятность рака выше или равна 95%);
BI-RADS 6 — подтвержденный биопсией РМЖ.
BI-RADS 3 и 6, согласно рекомендациям онкологов, не используются при скрининге6 [18]. Категория BI-RADS 3 является сложной для дальнейшего прогнозирования, определяет широкий спектр действий для маршрутизации пациентки и часто используется в ситуациях, когда картина не совсем ясна. Применение этой категории при формировании заключения в неясных случаях может привести как к гипер-, так и к гиподиагностике [20]:
— неоправданному наблюдению за изменениями, которые могли бы быть оценены как доброкачественные;
— несвоевременной диагностике некоторых видов рака с неспецифическими проявлениями.
Поскольку категория BI-RADS 3 предполагает динамическое наблюдение через 6 мес., в случае если образование оказалось всё же злокачественным, такая тактика может привести к верификации рака уже на продвинутой стадии.
Поэтому, перед тем как будет рекомендовано повторное исследование, пациентке должны быть проведены все доступные дополнительные обследования, в том числе УЗИ дообследование и/или МРТ с контрастированием. Учитывая перечисленные данные не рекомендовано использовать категорию BI-RADS 3 при скрининге РМЖ; при впервые выявленном объемном образовании, даже без явных рентгенологических признаков злокачественности; при выявлении пальпируемых образований; если нет уверенности в том, к какой категории относятся изменения (2 или 4), целесообразно выставлять категорию BI-RADS 4 [21].
Категория BIRADS 6 не используется при скрининге, поскольку обозначает гистологически подтвержденный РМЖ и ставится в случаях наблюдения и оценки эффективности терапии уже верифицированного РМЖ: неоперированного РМЖ; при оценке эффективности химиотерапии или лучевой терапии [22].
Цифровая РМГ повышает эффективность скрининга новообразований молочной железы за счет дополнительных опций варьирования яркости, контрастности, инверсии, масштабирования и других характеристик изображения для лучшей визуализации изменений. Это способствует повышению чувствительности цифровой РМГ, что подтверждают работы, где доля диагностированных новообразований при скрининговой цифровой РМГ составила 7,8 на 1 000 обследованных, при аналоговой РМГ 5,5 на 1 000 женщин [23].
Раздел 3. Организация скрининга рака молочной железы в рамках диспансеризации определенных групп взрослого населения
3.1. Нормативные акты, регламентирующие организацию скрининга РМЖ в рамках ДОГВН:
- Федеральный закон от 21.11.2011 №323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации".
- Приказ Минздрава России от 27.04.2021 №404н "Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения".
- Приказ Минздрава России от 15.11.2012 №923н "Об утверждении порядка оказания медицинской помощи по профилю "терапия".
- Приказ Минздрава России от 19.02.2021 №116н "Об утверждении порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях".
- Приказ Минздрава России от 09.06.2020 №560н "Об утверждении правил проведения рентгенологических исследований".
- Приказ Минздрава России от 20.10.2020 №1130н "Об утверждении порядка оказания медицинской помощи по профилю "акушерство и гинекология".
- Приказ Минздрава России от 15.03.2006 №154 "О мерах совершенствования медицинской помощи при заболеваниях молочной железы".
- Приказ Минздрава России от 30.11.2017 №965н "Об утверждении порядка организации и оказания медицинской помощи с применением телемедицинских технологий".
Основные этапы программы скрининга РМЖ в рамках ДОГВН (Приложение)6 7:
- Привлечение целевой группы населения к прохождению скрининга РМЖ.Для привлечения целевой группы населения к прохождению скрининга РМЖ в рамках ДОГВН проводится информирование граждан о необходимости прохождения ДОГВН органами исполнительной власти в сфере здравоохранения, Территориальными фондами медицинского страхования, страховыми медицинскими организациями и медицинскими организациями, непосредственно реализующими мероприятия ДОГВН.
В медицинских организациях определяется ответственный персонал, отвечающий за оповещение прикрепленного населения о необходимости прохождения ДОГВН. Несомненным преимуществом скрининга РМЖ в рамках ДОГВН является отсутствие необходимости получения дополнительных согласований, документов, направлений для прохождения РМГ-скрининга, поскольку исследование заложено в первый этап ДОГВН у соответствующей категории пациентов (женщины 40-75 лет). Также широкая информационно-коммуникационная кампания, направленная на привлечение внимание к диспансеризации в целом и к важности прохождения онкологического скрининга в частности осуществляется региональными центрами общественного здоровья и медицинской профилактики через средства массовой информации (телевидение, радиоканалы, интернет-ресурсы), путем просвещения на профилактических акциях и днях здоровья.
- Организация и проведение массового маммографического обследования женщин в возрасте от 40 до 75 лет включительно в рамках 1 этапа ДОГВН. Проводится РМГ обеих молочных желез в двух проекциях с двойным прочтением рентгенограмм 1 раз в 2 года (за исключением случаев невозможности проведения исследования по медицинским показаниям в связи с мастэктомией). Исследование не проводится, если в течение предшествующих 12 мес. проводилась РМГ. В случае если при обращении гражданина для прохождения диспансеризации установлено, что исследование не проводилось ранее в установленные сроки, то исследование проводится при обращении. График последующих исследований смещается согласно рекомендуемой частоте проведения исследования7.
- Прием (осмотр) врачом-терапевтом по завершении первого этапа диспансеризации. По завершении первого этапа диспансеризации проводится прием врачом-терапевтом с осмотром, направленным на выявление визуальных и иных локализаций онкологических заболеваний, с анализом результатов исследований, проведенных на первом этапе ДОГВН, определением показаний для дополнительного обследования в рамках второго этапа ДОГВН и, при необходимости, вне рамок диспансеризации7. Женщины, которым при проведении РМГ установлена категория BIRADS 1, в дополнительном обследовании не нуждаются. Им проводится рутинный скрининг через 2 года.
- В рамках второго этапа диспансеризация проводится осмотр врачом-акушером-гинекологом (для женщин в возрасте от 40 до 75 лет с выявленными изменениями по результатам скрининга)7. Пациенткам с BIRADS 2 проводится рутинный скрининг через 2 года. Однако в связи с выявленными доброкачественными изменениями в молочной железе, они направляются врачом-терапевтом на консультацию акушера-гинеколога вне рамок диспансеризации. Дальнейшая маршрутизация осуществляется в соответствии с порядком оказания медицинской помощи по профилю "акушерство и гинекология". Пациентки с категорией BIRADS 4 или 5 направляются на консультацию врача-онколога вне рамок диспансеризации.
- Организация и проведение дополнительного обследования. При выявлении у пациента в процессе профилактического медицинского осмотра и (или) диспансеризации патологии других органов и систем, медицинских показаний к проведению осмотров (консультаций) врачами-специалистами, исследований и мероприятий, включая осмотр (консультацию) врачом-онкологом при выявлении подозрений на онкологические заболевания визуальных и иных локализаций, не входящих в объем профилактического медицинского осмотра и (или) диспансеризации, они назначаются и выполняются в соответствии с порядком оказания медицинской помощи по профилю выявленного или предполагаемого заболевания (состояния), с учетом стандартов медицинской помощи, а также на основе клинических рекомендаций7.
3.2. Требования к проведению РМГ при скрининге РМЖ в рамках ДОГВН
ДОГВН предполагает проведение РМГ на 1 этапе и при выявлении патологии — консультацию врача-акушера-гинеколога на втором этапе диспансеризации. Дополнительное обследование при выявлении в результате скрининга ЗНОМЖ (консультация онколога, УЗИ молочных желез, МРТ, биопсия и морфологическое исследование) проводится вне рамок ДОГВН.
Квалификация рентгенолога, оценивающего маммограммы, является ключевым фактором эффективности скрининга. При проведении РМГ-скрининга в рамках ДОГВН оценка маммограмм может осуществляться двумя способами:
- Оценка рентгенограмм двумя независимыми врачами-рентгенологами медицинской организации, реализующей ДОГВН, с формированием двух отдельных протоколов исследования. При скрининге РМЖ в рамках ДОГВН, для интерпретации маммограмм может использоваться программное обеспечение (ПО) с технологией искусственного интеллекта (ИИ) в качестве системы поддержки принятия врачебных решений. Изолированное использование заключения, автоматически сгенерированного ПО с технологией ИИ, недопустимо. Независимо от применения ИИ для интерпретации маммограмм заключение по РМГ формируется врачом-рентгенологом.
- Последовательная оценка рентгенограмм:
а) врачом-рентгенологом медицинской организации, реализующей ДОГВН, с формированием протокола заключения;
б) формирование протокола исследования врачом-рентгенологом сторонней медицинской организации, с применением телемедицинских технологий и/или программного обеспечения с технологией ИИ в качестве системы поддержки принятия врачебных решений для интерпретации РМГ.
Второй способ реализуется при наличии технической возможности.
При расхождении мнений рентгенологов дальнейший диагностический маршрут формируется исходя из заключения с более высокой категорией BI-RADS.
Согласно приказу Минздрава России №404н от 27.04.2021 "Об утверждении Порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения" первый этап диспансеризации рекомендуется проводить в течение одного рабочего дня. Таким образом, описание маммографических снимков, произведенных при скрининге ЗНОМЖ в рамках ДОГВН, должно осуществляться не позднее 1 рабочего дня с момента проведения обследования7,9. Двойное чтение снимков может организовываться, как в организации, где проводилось исследование, так и посредством дистанционных консультаций с применением телемедицинских технологий6.
В случае выявления изменений, подозрительных на ЗНО (BI-RADS 4,5) необходимо дополнительное обследование — пациентка направляется на консультацию акушера-гинеколога в рамках второго этапа ДОГВН и в дальнейшем — на консультацию онколога центра амбулаторной онкологической помощи/онкологического диспансера вне рамок диспансеризации7.
Требования к описанию маммограмм6 7 [16][18].
- Рентгенограммы должны оцениваться двумя независимыми специалистами с формированием отдельных заключений.
- Описание маммограмм, проводимых в рамках скрининга РМЖ должно включать следующие обязательные компоненты:
2.1. Определение типа МП каждой молочной железы (А, В, С. D) по соотношению плотных структур и жировой ткани.
Выявление высокой МП должно служить основанием для дообследования (проведения УЗИ или МРТ с контрастированием, контрастной двуэнергетической РМГ), так как информативность РМГ в таких случаях существенно снижается.
2.2. Описание структурных изменений молочных желез должно проводиться на основании международной системы BI-RADS и отражать наиболее значимые изменения6:
— изменение кожи, ареолы, соска;
— изменение подкожно-жировой клетчатки;
— тип рентгенологической плотности молочной железы;
— характер изменения ткани молочной железы;
— наличие узлового образования;
— наличие участка уплотнения (в одной проекции);
— наличие кальцинатов (размеры, разрозненные или сгруппированные, доброкачественные или подозрительной природы);
— нарушение архитектоники ткани молочной железы (локальная асимметрия/локальная тяжистая перестройка);
— асимметрия плотности ткани молочной железы (участки уплотненной структуры);
— характеристика интрамаммарных и подмышечных лимфатических узлов.
Для каждой молочной железы категория BI-RADS должна быть определена отдельно. В зависимости от выявленных при скрининговом исследовании изменений врачом-терапевтом принимается решение о дальнейшей маршрутизации в рамках ДОГВН (Приложение).
3.3. Физикальное обследование, проводимое врачом-терапевтом в рамках скрининга РМЖ, при приеме (осмотре) по результатам первого этапа ДОГВН
Важным этапом онкомаммоскрининга в рамках ДОГВН является прием (осмотр) по результатам первого этапа диспансеризации, направленный на выявление визуальных и иных локализаций онкологических заболеваний: осмотр кожных покровов, слизистых губ и ротовой полости, пальпацию щитовидной железы, лимфатических узлов, с целью установления диагноза заболевания (состояния), определения группы здоровья, группы диспансерного наблюдения, определения медицинских показаний для осмотров (консультаций) и исследований в рамках второго этапа диспансеризации7. Исследование состояния регионарных лимфатических узлов — очень значимый этап в диагностике и определении распространенности РМЖ. В некоторых случаях изменения лимфатических узлов могут наблюдаться даже при небольшом узловом образовании в молочной железе, либо при диффузных формах РМЖ, которые сложнее подвергаются диагностике на ранних этапах. Поэтому постоянная актуализация знаний по методике проведения осмотра кожных покровов, физикального исследования лимфатических узлов и об основных признаках патологических изменений лимфатических узлов, кожных покровов при РМЖ является важной составляющей профессионального совершенствования врача-терапевта, осуществляющего процесс диспансеризации.
Физикальное обследование начинают с осмотра молочных желез. Руки пациентки в начале осмотра опущены вдоль туловища. Оценивается состояние кожных покровов молочной железы: гиперемия, изменения сосудистого рисунка, отек, утолщение, эрозии, сыпь, изменения по типу "лимонной корки", симптом "площадки". Затем необходимо попросить пациентку поднять руки и завести их за голову, чтобы оценить появление/отсутствие выбуханий или втяжений кожи, изменение рельефа.
Необходимо обследовать регионарные лимфатические узлы.
Лимфоотток от различных отделов молочной железы происходит в следующие группы лимфатических узлов:
— подмышечные лимфатические узлы делятся на пять подгрупп: латеральные (наружные), медиальные (грудные, парамаммарные), средние (центральные), задние (подлопаточные), верхушечные (апикальные);
— парастернальные лимфатические узлы;
— межпекторальные лимфатические узлы;
— субпекторальные лимфатические узлы;
— подключичные лимфатические узлы;
— надключичные лимфатические узлы.
Доступными пальпации являются надключичные, подключичные и подмышечные лимфатические узлы.
Пальпацию проводят сомкнутыми пальцами кисти. Пальпируют область надключичной ямки. Надключичное пространство исследуется от грудино-ключично-сосцевидной мышцы до ключично-акромиального сочленения. Далее исследуются подключичные лимфатические узлы. При пальпации подключичных лимфоузлов исследуется пространство под ключицей до краев дельтовидных мышц. Далее пальпируются подмышечные лимфоузлы от вершины подмышечной ямки вниз. Следует попросить пациентку расслабить руки, положив ладони себе на пояс. Первой пальпируется апикальная группа лимфоузлов. Затем пациентка должна опустить руки, после чего пальпируются остальные группы лимфатических узлов. Определяют величину, консистенцию, количество, подвижность и болезненность лимфатических узлов. В норме лимфатические узлы не пальпируются, либо могут определяться одиночные, эластической консистенции, подвижные, величиной не более одного сантиметра в подмышечной, паховой или подчелюстной областях. При наличии увеличенных лимфатических узлов обязательно указывают их размеры, болезненность, консистенцию, подвижность и спаянность с кожей и окружающими тканями. Лимфатические узлы с метастазами увеличены в размере, плотные при пальпации, при прорастании капсулы могут становиться малоподвижными или образовывать конгломераты.
3.4. Основные клинические проявления РМЖ, выявляемые при физикальном обследовании
Проводя физикальное обследование во время приема по результатам первого этапа ДОГВН, врач-терапевт должен знать о клинических проявлениях различных форм РМЖ. Достаточная информированность врача-терапевта в вопросах клиники РМЖ необходима для верной интерпретации жалоб пациенток, обучения пациенток этапам самообследования, оценке выявленных при этом изменений, составления эффективного алгоритма дальнейшей диагностики.
Клинические формы РМЖ делятся на узловую, диффузную (отечно-инфильтративную, рожистоподобную, маститоподобную и панцирную), а также рак Педжета (поражает сосок и ареолу)10 [16].
- Узловая форма РМЖ10[16]
Основным проявлением данной формы РМЖ является наличие узлового образования в ткани молочной железы. Клиническая симптоматика зависит от распространенности опухолевого процесса.
При ранних формах РМЖ клиническими признаками являются:
— опухолевый узел плотной консистенции в ткани молочной железы;
— ограничение подвижности новообразования при инфильтративной форме роста;
— отсутствие болезненности при пальпации новообразования;
— наличие одного или нескольких безболезненных плотных подмышечных лимфоузлов со стороны пораженной молочной железы;
— возможно появление кровянистых выделений из соска (при внутрипротоковом раке и внутрипротоковой папилломе).
При распространенных стадиях РМЖ могут выявляться следующие симптомы:
— изменения рельефа кожи в проекции новообразования;
— симптом "умбиликации" — появление участка втяжения кожи над опухолью;
— симптом "лимонной корки" над опухолью и/или за ее пределами;
— прорастание кожи опухолью и/или изъязвление кожи;
— утолщение соска и складки ареолы (симптом Краузе);
— втяжение и фиксация соска;
— деформация молочной железы, изменение размеров, подтягивание ее вверх, фиксация к грудной стенке;
— множественные плотные малоподвижные лимфатические узлы или конгломераты лимфоузлов в подмышечной области на стороне опухоли;
— пальпируемые плотные надключичные лимфатические узлы на стороне опухоли.
- Диффузная форма10 [11][16]
При диффузной форме РМЖ отмечается гиперемия кожи молочной железы, увеличение размеров железы, отечность, локальная гипертермия, диффузное уплотнение ткани молочной железы, изменения всей кожи железы по типу "лимонной корки", утолщение, втяжение и фиксация соска, плотные подмышечные лимфатические узлы со стороны пораженной железы в результате метастазирования.
При диффузной форме РМЖ опухолевый узел в тканях молочной железы может не выявляться — такие формы рака относятся к первичным диффузным. Выделяют также вторичные диффузные формы РМЖ, при этом в молочной железе выявляется опухолевый узел, отек и уплотнение тканей обусловлено нарушениями лимфооттока.
- Рак Педжета10
Для данной формы РМЖ характерно появление покраснения и утолщения соска, появление сухих и мокнущих корок в области ареолы и соска, а в последующем и изъязвлений. В дальнейшем сосок уплощается, рост опухоли распространяется вглубь молочной железы, возможно формирование опухолевого узла. Метастазы в регионарных лимфатических узлах появляются позже.
Глава II. ОСНОВЫ ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ
Раздел 1. Самообследование молочных желез
Одним из методов, способствующих раннему выявлению новообразований молочных желез является самообследование. Это простая и эффективная методика позволяет женщинам самостоятельно выявить изменения тканей молочной железы и своевременно обратиться за медицинской помощью.
Большое количество экспертов признает, что самообследование молочных желез остается полезным и важным методом, способствующим повышению внимания пациентки к изменениям в молочных железах и, как следствие, своевременному обращению к врачу и раннему выявлению новообразований в тканях молочной железы [24][25]. Медико-санитарное просвещение по этому вопросу крайне важно, поскольку позволяет донести до пациенток информацию об основных физикальных признаках и симптомах РМЖ, обучить верной методике самообследования.
Важно информировать пациенток о верной методике самообследования молочных желез.
При сохранном менструальном цикле самообследование рекомендуется проводить на 5-6 день от начала менструации, при наступлении менопаузы — в одно и то же число каждого месяца. Не следует проводить самообследование чаще, чем один раз в месяц.
Самообследование молочных желез состоит из 6 этапов11:
- Осмотр белья11.
Необходимо внимательно осмотреть бюстгальтер на предмет наличия желтоватых, кровянистых или бурых пятен. При малом количестве выделений, заметить их достаточно сложно, но они, как правило, оставляют следы на белье, поэтому осмотр белья является важным этапом самообследования.
- Осмотр молочных желез11.
Осмотр молочных желез производится в хорошо освещенном помещении перед зеркалом, сначала в положении стоя с опущенными руками, затем в положении стоя с поднятыми вверх руками.
— Осмотр молочных желез в зеркале в положении стоя с опущенными руками (рисунок 2).
Оцениваемые параметры: изменения формы, величины молочных желез, их симметричность, наличие/отсутствие смещения или фиксации при наклонах, поворотах туловища;
— Осмотр молочных желез в зеркале в положении стоя с поднятыми вверх руками (рисунок 3).
Оцениваемые параметры: наличие/отсутствие смещения или фиксации молочных желез; изменение формы, локальное выбухание или втяжение участка кожи/соска при поднятии рук и заведении рук за голову.
- Оценка состояния кожных покровов молочных желез11.
Оцениваемые параметры: изменения цвета кожи; эластичность кожных покровов; наличие/отсутствие участков уплотнения кожи; наличие/отсутствие гиперемии, элементов сыпи, опрелостей, изъязвлений, изменений, по типу "лимонной корки", уплотнений, выбуханий, втянутости, изъязвлений и сморщенности кожи.
- Пальпация молочных желез в положении стоя11.
Проводится подушечками четырех или трех сомкнутых пальцев (большой палец не задействован при пальпации), круговыми проникающими движениями, вначале — поверхностно, затем — глубоко обследуя ткань железы. Необходимо обследовать область от ключицы до края реберной дуги и от края грудины до средней подмышечной линии. Очень важно также обследовать подмышечную область. Правой рукой обследуется область левой молочной железы, левой рукой — область правой молочной железы (рисунок 4).
Для большего удобства данный этап пальпации может проводится в душе, намыленными руками либо с использованием крема или лосьона, поскольку таким образом процесс пальпации облегчается.
- Пальпация молочных желез в положении лежа11.
Данный этап самообследования проводится лежа на плоской жесткой поверхности. При этом рука со стороны обследуемой молочной железы должна быть расположена либо вдоль туловища, либо заведена за голову (рисунок 5). Пальпация может производиться двумя методами:
— Метод квадратов: по данной методике поверхность грудной клетки со стороны обследуемой железы, расположенная в границах от ключицы до края реберной дуги и от края грудины до средней подмышечной линии, делится на квадраты, после чего проводится пальпация каждого квадрата сверху вниз;
— Метод спирали: пальпация каждой молочной железы производится по спирали, перемещая пальцы по концентрически сходящимся окружностям, круговыми движениями, начиная исследование от подмышечной области и завершая у соска, таким образом захватывая ткани всей молочной железы.
- Обследование сосков.
Обследование сосков производится методами осмотра и пальпации11.
— При проведении осмотра сосков оценивается наличие/отсутствие втянутости, изменений формы и цвета сосков, выделений, трещин, изъязвлений.
— При пальпации производится исследование соска и прилежащих тканей молочной железы; для оценки наличия выделений необходимо осторожно сдавить сосок большим и указательным пальцами фиксируя появление/отсутствие выделений и их характер (рисунок 6).

Рис. 2. Осмотр молочных желез в зеркале в положении стоя с опущенными руками.
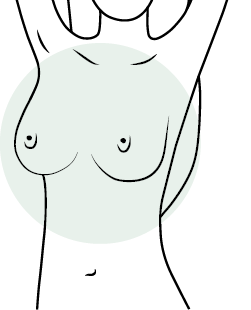
Рис. 3. Осмотр молочных желез в зеркале в положении стоя с поднятыми вверх руками.

Рис. 4. Пальпация молочных желез в положении стоя.
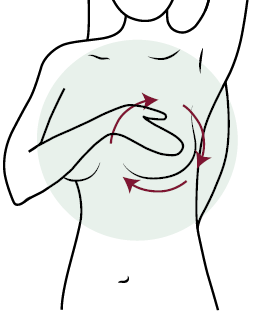
Рис. 5. Пальпация молочных желез в положении лежа.
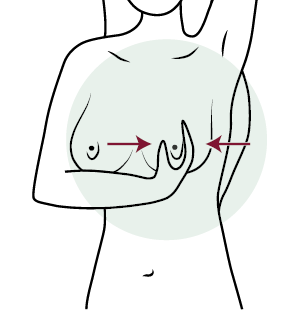
Рис. 6. Обследование сосков.
Раздел 2. Профилактика злокачественных новообразований молочной железы
Цель первичной профилактики РМЖ — предотвратить процесс канцерогенеза и инвазивного роста. По данным современных исследований, до 50% случаев РМЖ может быть предотвращено путем воздействия на факторы риска развития заболевания12. Развитие РМЖ обусловлено комбинированным воздействием канцерогенов и факторов риска. Факторы риска сами по себе не определяют развитие РМЖ, а лишь в той или иной степени способствуют его развитию.
Многочисленные исследования свидетельствуют о влиянии на развитие РМЖ следующих факторов риска:
- Модифицируемые факторы риска РМЖ:
— физическая активность — низкая физическая активность ассоциирована с повышением риска РМЖ и является одним из самых значимых факторов риска, что доказано многочисленными клиническими исследованиями, причем повышение физической активности достоверно приводит к снижению риска РМЖ независимо от наличия ожирения и менопаузы [26][27];
— табакокурение — потребление табака ассоциировано с повышенным риском РМЖ, причем имеются данные, что ранний возраст начала курения, большая продолжительность курения и количество сигарет дополнительно увеличивают этот риск [28];
— потребление алкоголя — многочисленные исследования свидетельствуют о связи употребления алкоголя с развитием восьми видов рака, в том числе РМЖ [29];
— характер питания — повышенное потребление красного и переработанного мяса, насыщенных жиров и простых углеводов ассоциировано с повышением риска РМЖ [30][31];
— избыточная масса тела, ожирение — имеющиеся к настоящему времени данные указывают на связь избыточной массы тела и ожирения (в особенности абдоминального типа) с увеличением риска РМЖ, прежде всего у женщин в постменопаузе [32-35];
— репродуктивный анамнез — поздние первые роды (после 35 лет) или отсутствие родов, нарушения или короткие периоды лактации ассоциированы с увеличением риска РМЖ, тогда как увеличение количества родов, ранние первые роды (до 25 лет) снижают пожизненный риск ЗНОМЖ [36][37];
— неконтролируемый прием эстроген-прогестероновых препаратов в рамках заместительной гормональной терапии [38][39].
- Немодифицируемые факторы риска РМЖ:
— наследственность — риск РМЖ у женщин, имеющих двух и более родственников, страдавших РМЖ в 2,5 раза больше, чем в общей популяции и увеличивается при большем количестве случаев рака в семье [40]; наиболее часто наследственный рак связан мутациями в генах BRCA1 и BRCA2 (5-10% РМЖ в разных популяциях), для носителей мутаций BRCA1 и BRCA2 кумулятивный риск РМЖ составляет 70%, а при дополнительном наличии родственников, больных РМЖ, риск увеличивается до 90% [41][42]; к настоящему времени обнаружен еще ряд генов, в разной степени влияющих на предрасположенность к РМЖ [43];
— возраст — риск РМЖ увеличивается с возрастом и достигает максимума в старших возрастных группах, о чем свидетельствует статистика [1], однако в последние десятилетия наблюдается увеличение числа случаев РМЖ у женщин 40-49 лет и женщин младше 40 лет, указанная тенденция привела к выделению группы пациенток РМЖ "очень молодого возраста" — до 35 лет [2];
— гинекологические факторы:
- раннее менархе и поздняя менопауза ассоциированы с риском РМЖ [22];
- уровень половых гормонов — у женщин с высоким уровнем эндогенных половых стероидных гормонов (эстрон, эстрадиол, тестостерон) риск возникновения РМЖ вдвое выше, чем у женщин с низким уровнем этих гормонов [44][45];
— повышенная МП у женщин пострепродуктивного периода — данные многочисленных зарубежных клинических исследований свидетельствуют о том, что высокая МП у женщин пострепродуктивного периода является независимым фактором риска развития РМЖ (NCCN, 2017) [46][47];
— доброкачественные новообразования молочной железы в анамнезе — результаты онко-эпидемиологических и молекулярно-генетических исследований свидетельствуют о снижении противоопухолевой активности при некоторых формах мастопатии (например, при пролиферативной форме мастопатии, атипичной гиперплазии молочной железы, фибросклерозе, некоторых формах кист молочной железы). Риск РМЖ увеличивается в несколько раз [48][49].
Профилактические мероприятия должны быть направлены на борьбу с модифицируемыми факторами риска, выявление групп риска с последующим контролем необходимых показателей, лечение предраковых заболеваний, эффективный скрининг РМЖ.
В реализации мероприятий по профилактике РМЖ большое значение имеет повышение санитарно-гигиенической грамотности населения. Получение пациенткой исчерпывающей информации о выявленных у нее факторах риска заболевания, необходимых мерах по их модификации и мотивация к выполнению рекомендаций являются залогом эффективной профилактики РМЖ. По данным масштабного клинического исследования, около 35% РМЖ у женщин в менопаузе можно предотвратить путем коррекции модифицируемых факторов риска [50]. Другое исследование показало снижение риска РМЖ на 24% при соблюдении мер профилактики [51]. Таким образом, индивидуальное профилактическое консультирование с предоставлением корректной информации крайне важно. Профилактика РМЖ должна быть персонализированной, то есть проводиться на основе анализа факторов риска каждой конкретной пациентки. Осуществление мер профилактики РМЖ находится в сфере компетенций и организационных возможностей первичного звена здравоохранения. Популяционный скрининг РМЖ, проводимый в рамках ДОГВН, и последующее профилактическое консультирование дают возможность довести до сведения пациенток исчерпывающую информацию, разъяснить меры коррекции выявленных у конкретной пациентки факторов риска и, таким образом, внести весомый вклад в профилактику РМЖ. Безусловно важным компонентом профилактики является повышение информированности и соответствующая профессиональная подготовка врачей и фельдшеров первичного звена.
Заключение
В настоящее время наиболее важным и эффективным способом увеличения частоты выявления РМЖ на начальных (неинвазивных стадиях), является широкий охват целевой группы мероприятиями скрининга, основанного на внедрении и развитии технологий РМГ, что во всем мире привело к значимым успехам в снижении смертности. РМГ в качестве скринингового метода в рамках ДОГВН позволяет обеспечить широкий охват целевых групп населения. Высокая квалификация и опыт медицинских работников, осуществляющих скрининг, имеют решающее значение для обеспечения качества и эффективности обследования. Медицинский специалист должен обладать клиническими навыками и ресурсами для выявления онкологического заболевания. Проведение скрининга РМЖ в рамках ДОГВН обеспечивается междисциплинарным взаимодействием команды медицинских работников. Поэтому важна постоянная актуализация знаний персонала, непосредственно обеспечивающего проведение скрининга РМЖ в рамках ДОГВН (врачей-рентгенологов, терапевтов, акушеров-гинекологов, онкологов), а также административного персонала, осуществляющего планирование, координацию и контроль указанных мероприятий.
Обучение правилам получения качественных маммограмм, верной интерпретации полученных изображений, описания и формирования заключений по данным РМГ, соблюдению порядка маршрутизации при скрининге РМЖ в рамках ДОГВН должно стать обязательным элементом подготовки в медицинских учебных заведениях высшего и среднего профессионального образования, а также в системе последипломной подготовки медицинских работников.
Методологически верное выполнение всех мероприятий онкологического скрининга позволит увеличить процент диагностики РМЖ на ранних доклинических стадиях и обеспечить таким образом снижение показателей инвалидизации и смертности.
Также крайне важно повышение информированности целевой группы населения о факторах риска, способах их коррекции, симптомах, при которых необходимо обратиться за медицинской помощью. Доведение информации о верной методике самообследования молочных желез, особенно в группе повышенного риска РМЖ, крайне важно и также требует соответствующих знаний от медицинских работников.
Данное издание содержит необходимую для врачей-терапевтов, врачей общей практики, акушер-гинекологов, онкологов, организаторов здравоохранения информацию о методике корректного выполнения медицинскими работниками необходимых мероприятий скрининга РМЖ, что будет способствовать увеличению эффективности скрининга и ранней диагностики РМЖ в рамках ДОГВН.
Приложение
Алгоритм организации скрининга РМЖ в рамках ДОГВН6 7
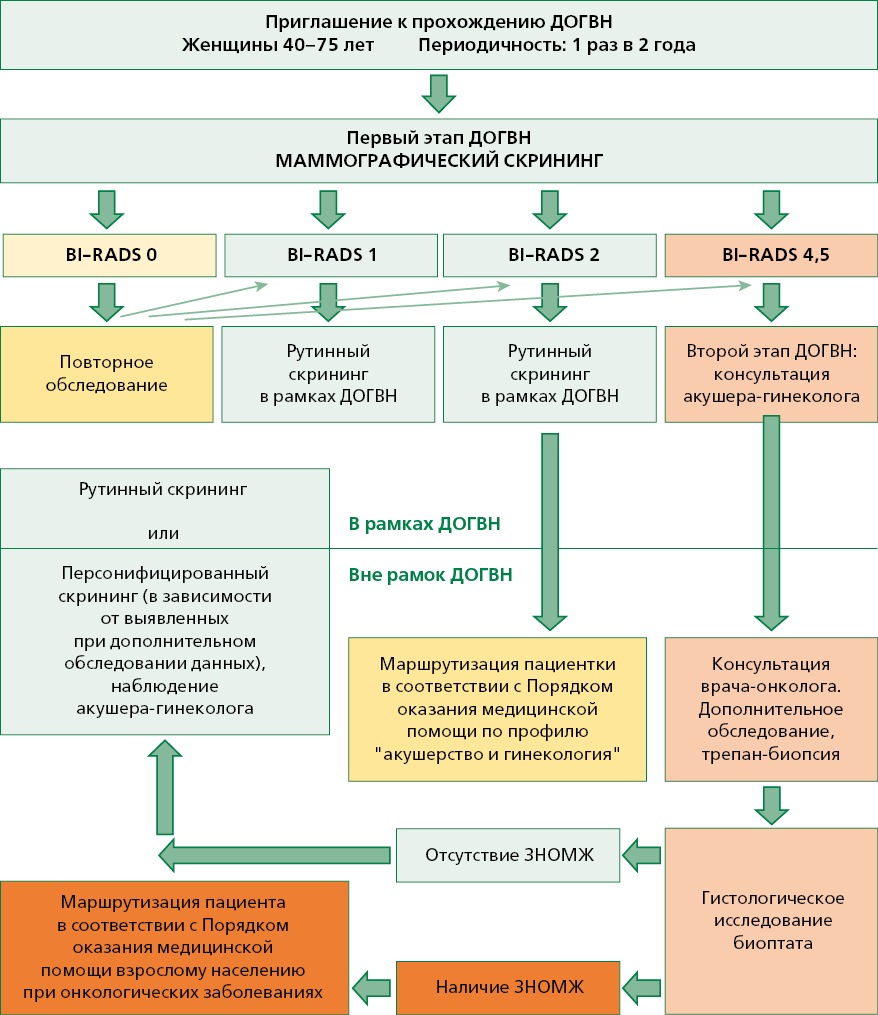
Сокращения: ДОГВН — диспансеризация определенных групп взрослого населения, ЗНОМЖ — злокачественные новообразования молочной железы, РМЖ — рак молочной железы.
1 Cancer today: [Электронный ресурс]. GLOBOCAN. URL: https://gco.iarc.fr (06.04.2024).
2 Рак молочной железы: [Электронный ресурс]. Всемирная организация здравоохранения. URL: https://www.who.int/ru (06.04.2024).
3 Wilson JMG, Jungner G. Principles and practice of screening for disease. Geneva: World Health Organization; 1968.
4 Программы скрининга: краткое руководство. Повышение эффективности, максимальное увеличение пользы и минимизация вреда. [Screening programmes: a short guide. Increase effectiveness, maximize benefits and minimize harm]. Копенгаген: Европейское региональное бюро ВОЗ; 2020. Лицензия: CC BY-NC-SA 3.0 IGO.
5 WHO Position Paper on Mammography Screening. World Health Organization, 2014.
6 Методические рекомендации по выполнению программы популяционного скрининга ЗНО молочной железы среди женского населения. М.: Министерство здравоохранения Российской Федерации, 2019, с. 40.
7 Приказ Минздрава России от 27.04.2021 № 404н "Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения".
8 Radiation and Health Effects: [Электронный ресурс]. World Nuclear Assotiation. URL: https://www.world-nuclear.org. (26.11.2023).
9 Приказ Минздрава России от 09.06.2020 №560н "Об утверждении правил проведения рентгенологических исследований".
10 Клинические рекомендации "Рак молочной железы", 2021. Минздрав России.
11 Клинические рекомендации "Доброкачественная дисплазия молочной железы", 2020. Минздрав России.
12 Golubnitschaja O, Debald M, Yeghiazaryan K, et al. Breast cancer epidemic in the early twenty-first century: evaluation of risk factors, cumulative questionnaires and recommendations for preventive measures. Tumor Biol. 2016;37:12941-57. doi:10.1007/s13277-016-5168-x.
Список литературы
1. Злокачественные новообразования в России в 2022 году (заболеваемость и смертность). Под ред. Каприна А.Д., Старинского В.В., Шахзадовой А.О. М.: МНИОИ им. П.А. Герцена — филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2023. илл. 275 с. ISBN: 978-5-85502-290-2.
2. Кравченко Д.Н., Пароконная А.А., Нечушкин М.И. и др. Рак молочной железы у больных молодого возраста. Особенности прогноза и адъювантной гормонотерапии (обзор литературы). Опухоли женской репродуктивной системы. 2018;15(3):55-63. doi:10.17650/1994-4098-2018-14-3-55-63.
3. Драпкина О.М., Самородская И.В. Скрининг: терминология, принципы и международный опыт. Профилактическая медицина. 2019;22(1):90-7. doi:10.17116/profmed20192201190.
4. Mandrik O, Zielonke N, Meheus F, et al. Systematic reviews as a ‘lens of evidence’: Determinants of benefits and harms of breast cancer screening. Int J Cancer. 2019;145(4):994-1006. doi:10.1002/ijc.32211.
5. Захарова Н.А., Семиглазов В.Ф., Манихас Г.М. Клинические рекомендации РООМ по скринингу РМЖ. Клинические рекомендации общероссийской общественной организации Роом по диагностике и лечению РМЖ. Москва: Издательский дом "АБВ-пресс", 2017. С. 67-90. EDN AFSSHK.
6. Оксанчук Е.А., Меских Е.В., Колесник А.Ю. и др. Эволюция рентгенологического метода исследования молочных желез. Вестник Российского научного центра рентгенорадиологии. 2017;17(2):1. EDN ZGIDKH.
7. Independent UK Panel on Breast Cancer Screening. The benefits and harms of breast cancer screening: an independent review. Lancet. 2012;380(9855):1778-86. doi:10.1016/S0140-6736(12)61611-0.
8. Mattsson A, Leitz W, Rutqvist LE. Radiation risk and mammographic screening of women from 40 to 49 years of age: effect on breast cancer rates and years of life. Br J Cancer. 2000;82(1):220-6. doi:10.1054/bjoc.1999.0903.
9. Yaffe MJ, Mainprize JG. Risk of radiation-induced breast cancer from mammographic screening. Radiology. 2011;258(1):98-105. doi:10.1148/radiol.10100655. Erratum in: Radiology. 2012;264(1):306.
10. Онищенко Г. Г., Попова А.Ю., Романович И.К. и др. Современные принципы обеспечения радиационной безопасности при использовании источников ионизирующего излучения в медицине. Часть 2. Радиационные риски и совершенствование системы радиационной защиты. Радиационная гигиена. 2019;12(2):6-24. doi:10.21514/1998-426Х-2019-12-2-6-24.
11. Mammology. National guidelines. A short edition. Edited by A.D. Kaprin, N.I. Rozhkova. M.: GEOTAR-Media, 2021. 384 p. (In Russ.) Маммология. Национальное руководство. Краткое издание. Под ред. А.Д. Каприна, Н.И. Рожковой. М.: ГЭОТАР-Медиа, 2021. 384 с. ISBN: 978-5-9704-6128-0.
12. Miller AB, To T, Baines CJ, Wall C. The Canadian National Breast Screening Study-1: breast cancer mortality after 11 to 16 years of follow-up. A randomized screening trial of mammography in women age 40 to 49 years. Ann Intern Med. 2002;137(5 Part 1):305-12. doi:10.7326/0003-4819-137-5_part_1-200209030-00005.
13. Paci E; EUROSCREEN Working Group. Summary of the evidence of breast cancer service screening outcomes in Europe and first estimate of the benefit and harm balance sheet. J Med Screen. 2012;19 Suppl 1:5-13. doi:10.1258/jms.2012.012077.
14. Gunsoy NB, Garcia-Closas M, Moss SM. Estimating breast cancer mortality reduction and overdiagnosis due to screening for different strategies in the United Kingdom. Br J Cancer. 2014;110(10):2412-9. doi:10.1038/bjc.2014.206.
15. Marmot MG, Altman DG, Cameron DA, et al. The benefits and harms of breast cancer screening: an independent review. Br J Cancer. 2013;108(11):2205-40. doi:10.1038/bjc.2013.177.
16. Медицинская логистика выявления рака молочной железы. Под ред. Каприна А.Д., Рожковой Н.И., М.: ГЭОТАР-Медиа, 2024, 345 с. ISBN: 978-5-9704-7805-9.
17. Драпкина О.М., Дроздова Л.Ю., Калинина А.М. и др. Организация проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения. Методические рекомендации. Издание 2-е. М.: ФГБУ "НМИЦ ТПМ" Минздрава России, 2020. 232 с. ISBN: 978-5-6043991-1-8.
18. Блудов А.Б., Кочергина Н.В., Щипахина Я.А. и др. Информационные системы и телемедицина: современные возможности улучшения скрининга рака молочной железы. Диагностическая и интервенционная радиология. 2017;11(4):16-24. EDN ZWTRQZ.
19. 2013 ACR BI-RADS Atlas: Breast Imaging Reporting and Data System. Carl J. D’Orsi, Edward A. Sickles, Ellen B. Mendelson, Elizabeth A. Morris. American College of Radiology, 2014, р. 689. ISBN: 155903016X, 9781559030168.
20. Spak DA, Plaxco JS, Santiago L, Dryden MJ, Dogan BE. BI-RADS® fifth edition: A summary of changes. Diagn Interv Imaging. 2017;98(3):179-90. doi:10.1016/j.diii.2017.01.001.
21. Климова Н.В., Кузнецов А.А. BI-RADS 3 — наблюдение или действие? (лекция). Радиология — практика. 2023;(3):24-35. doi:10.52560/2713-0118-2023-3-24-35.
22. Мануйлова О.О., Павлова Т.В., Диденко В.В. и др. Методические рекомендации по использованию международной системы BI-RADS при маммографическом обследовании. Методические рекомендации. М.: Федеральное государственное бюджетное образовательное учреждение высшего образования "Академия акварели и изящных искусств Сергея Андрияки", 2017. 23 с. EDN ZQSRXP.
23. Timmers J, Voorde MT, Engen RE, et al. Mammography with and without radiolucent positioning sheets: Comparison of projected breast area, pain experience, radiation dose and technical image quality. Eur J Radiol. 2015;84(10):1903-9. doi:10.1016/j.ejrad.2015.07.005.
24. Kösters JP, Gøtzsche PC. Regular self-examination or clinical examination for early detection of breast cancer. Cochrane Database Syst Rev. 2003;2003(2):CD003373. doi:10.1002/14651858.CD003373.
25. Семиглазов В.Ф., Манихас А. Г., Моисеенко В.М., и др. Результаты перспективного рандомизированного обследования [Россия (Санкт-Петербург)/ГОЛОС] значение самообследования в раннем выявлении рака молочной железы. Вопросы онкологии. 2003;49(4):434-41.
26. Pizot C, Boniol M, Mullie P, et al. Physical activity, hormone replacement therapy and breast cancer risk: A metaanalysis of prospective studies. Eur J Cancer. 2016;52:138-54. doi:10.1016/j.ejca.2015.10.063.
27. Antony MP, Surakutty B, Vasu TA, Chisthi M. Risk factors for breast cancer among Indian women: A case-control study. Niger J Clin Pract. 2018;21(4):436-42. doi:10.4103/njcp.njcp102_17.
28. Wang K, Li F, Zhang X, Li Z, Li H. Smoking increases risks of all-cause and breast cancer specific mortality in breast cancer individuals: a dose-response metaanalysis of prospective cohort studies involving 39725 breast cancer cases. Oncotarget. 2016;7(50):83134-47. doi:10.18632/oncotarget.13366.
29. Rehm J, Shield KD. Alcohol Use and Cancer in the European Union. Eur Addict Res. 2021;27(1):1-8. doi:10.1159/000507017.
30. Chen S, Chen Y, Ma S, et al. Dietary fibre intake and risk of breast cancer: A systematic review and meta-analysis of epidemiological studies. Oncotarget. 2016;7(49):80980-9. doi:10.18632/oncotarget.13140.
31. Romieu II, Amadou A, Chajes V. The Role of Diet, Physical Activity, Body Fatness, and Breastfeeding in Breast Cancer in Young Women: Epidemiological Evidence. Rev Invest Clin. 2017;69(4):193-203. doi:10.24875/ric.17002263.
32. Picon-Ruiz M, Morata-Tarifa C, Valle-Goffin JJ, et al. Obesity and adverse breast cancer risk and outcome: Mechanistic insights and strategies for intervention. CA Cancer J Clin. 2017;67(5):378-97. doi:10.3322/caac.21405.
33. Simone V, D’Avenia M, Argentiero A, et al. Obesity and Breast Cancer: Molecular Interconnections and Potential Clinical Applications. Oncologist. 2016;21(4):404- 17. doi:10.1634/theoncologist.2015-0351.
34. Cao S, Zhou J, Zhu Z, et al. Adult weight change and the risk of pre- and postmenopausal breast cancer in the Chinese Wuxi Exposure and Breast Cancer Study. Breast Cancer Res Treat. 2019;173(3):647-55. doi:10.1007/s10549-018-5016-3.
35. Coleman WB. Obesity and the breast cancer methylome. Curr Opin Pharmacol. 2016;31:104-13. doi:10.1016/j.coph.2016.11.006.
36. Dall G, Risbridger G, Britt K. Mammary stem cells and parity-induced breast cancer protection- new insights. J Steroid Biochem Mol Biol. 2017;170:54-60. doi:10.1016/j.jsbmb.2016.02.018.
37. Wu Y, Wang M, Sun W, et al. Age at last birth and risk of developing breast cancer: a meta-analysis. Eur J Cancer Prev. 2020;29(5):424-32. doi:10.1097/CEJ.000.
38. Белицкий Г. А., Кирсанов К.В., Лесовая Е. А., Максимова В. П., Соленова Л. Г., Якубовская М. Г. Химический канцерогенез и первичная профилактика рака. М.: Издательский дом "АБВ-пресс", 2020, 491 с.: ил., ISBN: 978-5- 6044613-1-0.
39. Bethea TN, Rosenberg L, Hong CC, et al. A casecontrol analysis of oral contraceptive use and breast cancer subtypes in the African American Breast Cancer Epidemiology and Risk Consortium. Breast Cancer Res. 2015;17(1):22. doi:10.1186/s13058-015-0535-x.
40. Brewer HR, Jones ME, Schoemaker MJ, et al. Family history and risk of breast cancer: an analysis accounting for family structure. Breast Cancer Res Treat. 2017;165(1):193-200. doi:10.1007/s10549-017-4325-2.
41. Franceschini G, Di Leone A, Terribile D, et al. Bilateral prophylactic mastectomy in BRCA mutation carriers: what surgeons need to know. Ann Ital Chir. 2019; 90:1-2.
42. Liu R, Kitamura Y, Kitamura T, et al; Three-Prefecture Cohort Study Group. Reproductive and lifestyle factors related to breast cancer among Japanese women: An observational cohort study. Medicine (Baltimore). 2019;98(51):e18315. doi:10.1097/MD.0000000000018315.
43. Yoshida R. Hereditary breast and ovarian cancer (HBOC): review of its molecular characteristics, screening, treatment, and prognosis. Breast Cancer. 2021;28(6):1167-80. doi:10.1007/s12282-020-01148-2.
44. Key TJ, Appleby PN, Reeves GK, et al.; Endogenous Hormones and Breast Cancer Collaborative Group. Steroid hormone measurements from different types of assays in relation to body mass index and breast cancer risk in postmenopausal women: Reanalysis of eighteen prospective studies. Steroids. 2015;99(Pt A):49-55. doi:10.1016/j.steroids.2014.09.001.
45. Sampson JN, Falk RT, Schairer C, et al. Association of Estrogen Metabolism with Breast Cancer Risk in Different Cohorts of Postmenopausal Women. Cancer Res. 2017;77(4):918-25. doi:10.1158/0008-5472.CAN-16-1717.
46. Nazari SS, Mukherjee P. An overview of mammographic density and its association with breast cancer. Breast Cancer. 2018;25(3):259-67. doi:10.1007/s12282-018-0857-5.
47. Bae JM, Kim EH. Breast Density and Risk of Breast Cancer in Asian Women: A Metaanalysis of Observational Studies. J Prev Med Public Health. 2016;49(6):367-75. doi:10.3961/jpmph.16.054.
48. Рожкова Н.И., Бурдина И.И., Запирова С.Б., Мазо М.Л., Прокопенко С.П., Якобс О.Э. Своевременное лечение диффузных гиперплазий — профилактика рака молочной железы. Онкогинекология. 2016;1:4-11.
49. Cuzick J, Sestak I, Cawthorn S, et al.; IBIS-I Investigators. Tamoxifen for prevention of breast cancer: extended long-term follow-up of the IBIS-I breast cancer prevention trial. Lancet Oncol. 2015;16(1):67-75. doi:10.1016/S1470-2045(14)71171-4.
50. Wang M, Pazaris M, Willett WC, et al. Population Attributable Risk of Modifiable and Nonmodifiable Breast Cancer Risk Factors in Postmenopausal Breast Cancer. Am J Epidemiol. 2016;184(12):884-93. doi:10.1093/aje/kww145.
51. Cifu G, Arem H. Adherence to lifestyle-related cancer prevention guidelines and breast cancer incidence and mortality. Ann Epidemiol. 2018;28(11):767-73. doi:10.1016/j.annepidem.2018.09.002.
Об авторах
О. М. ДрапкинаРоссия
Драпкина Оксана Михайловна — академик РАН, д.м.н., профессор, директор ФГБУ "НМИЦ ТПМ" Минздрава России, зав. кафедрой терапии и профилактической медицины ФГБОУ ВО "Российский университет медицины" Минздрава России, президент РОПНИЗ
Москва
А. Д. Каприн
Россия
Академик РАН, д.м.н., профессор, генеральный директор ФГБУ "НМИЦ радиологии" Минздрава России, президент Ассоциации онкологов России, вице-президент РОПНИЗ по направлению "Онкопрофилактика"
Москва
И. И. Алмазова
Россия
К.м.н., доцент кафедры терапии, общей врачебной практики с курсом гастроэнтерологии ФГБУ "НМИЦ ТПМ" Минздрава России
Москва
Л. Ю. Дроздова
Россия
К.м.н., руководитель лаборатории поликлинической терапии ФГБУ "НМИЦ ТПМ" Минздрава России
Москва
Е. С. Иванова
Россия
К.м.н., руководитель Отдела координации профилактики и укрепления общественного здоровья в регионах, руководитель Федерального Центра здоровья, ФГБУ "НМИЦ ТПМ" Минздрава России
Москва
Н. И. Рожкова
Россия
Д.м.н., профессор, зав. Национальным центром онкологии репродуктивных органов Московского научно-исследовательского онкологического института им. П. А. Герцена — филиала ФГБУ "НМИЦ радиологии" Минздрава России, профессор кафедры клинической маммологии, лучевой диагностики и лучевой терапии Факультета повышения квалификации медицинских работников Российского университета дружбы народов, президент Российской ассоциации маммологов
Москва
Н. А. Рубцова
Россия
Д.м.н., зав. отделом лучевой диагностики Московского научно-исследовательского онкологического института им. П. А. Герцена — филиала ФГБУ "НМИЦ радиологии" Минздрава России
Москва
Ж. В. Хайлова
Россия
К.м.н., зам. директора по организационно-методической работе МРНЦ им. А. Ф. Цыба — филиала ФГБУ "НМИЦ радиологии" Минздрава России, руководитель Центра координации деятельности учреждений регионов в области онкологии и радиологии ФГБУ "НМИЦ радиологии" Минздрава России
Москва
Р. Н. Шепель
Россия
К.м.н., зам. директора по перспективному развитию медицинской деятельности ФГБУ "НМИЦ ТПМ" Минздрава России, руководитель отдела научно-стратегического развития первичной медико-санитарной помощи, в.н.с. отдела научно-стратегического развития первичной медико-санитарной помощи, доцент кафедры терапии и профилактической медицины ФГБОУ ВО "Российский университет медицины" Минздрава России, доцент кафедры общественного здоровья и организации здравоохранения ФГБУ "НМИЦ ТПМ" Минздрава России
Москва
Рецензия
Для цитирования:
Драпкина ОМ, Каприн АД, Алмазова ИИ, Дроздова ЛЮ, Иванова ЕС, Рожкова НИ, Рубцова НА, Хайлова ЖВ, Шепель РН. Скрининг злокачественных новообразований молочной железы в рамках диспансеризации определенных групп взрослого населения. Методические рекомендации. Первичная медико-санитарная помощь. 2024;1(1):63-80. https://doi.org/10.15829/3034-4123-2024-5. EDN: VXVFHX
For citation:
Drapkina OM, Kaprin AD, Almazova II, Drozdova LY, Ivanova ES, Rozhkova NI, Rubtsova NA, Khailova JV, Shepel RN. Screening of malignant neoplasms of the breast as part of the medical examination of certain groups of the adult population. Guidelines. Primary Health Care (Russian Federation). 2024;1(1):63-80. (In Russ.) https://doi.org/10.15829/3034-4123-2024-5. EDN: VXVFHX






















